��Ŀ����
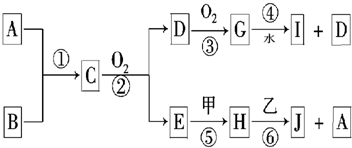
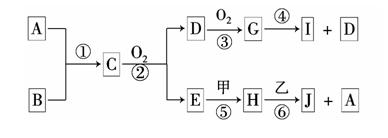
���ʼ��ת����ϵ����ͼ��ʾ��
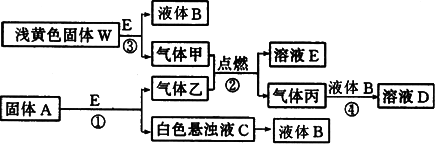
(1)д����Ӧ�۵����ӷ���ʽ________�����ɱ�״����5.6 L����ף���ת�Ƶ��ӵ����ʵ���Ϊ________mol��
(2)����A��һ����Ҫ�Ĺ�ҵԭ�ϣ�1 mol��������ȫȼ��ʱ����l mol��E��2 mol�������ҵĵ���ʽΪ________������ӿռ乹����________��
(3)C��Һ�е����ʺͱ������ʵ���֮��1��2��Ӧʱ���÷�Ӧ�����ӷ���ʽΪ________��
������ǡ����ȫ��Ӧ����A��W�����ʵ���֮��Ϊ________��
(4)��1 mol�����ͨ�뺬1.5 mol��B����Һ��ǡ����ȫ��Ӧ����ҺD����D��Һ�и�����Ũ���ɴ�С��˳����________��
�𰸣�
������
������
|
����(1)Na2O2��2H2O��4Na+��4OH����O2��(2��)��0.5 mol(2��) ����(2)H��C ����(3)CO2��OH����HCO3��(2��)��1��5(2��) ����(5)c(Na+)��c(HCO3��)��c(CO32��)��c(OH��)��c(H+)(3��) |

��ϰ��ϵ�д�
 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�
�����Ŀ