题目内容
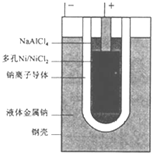 “ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔.下列关于该电池的叙述错误的是( )
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔.下列关于该电池的叙述错误的是( )分析:该原电池中,钠作负极,负极上电极反应式为:Na-e-=Na+,Ni/NiCl2作正极,正极上电极反应式为:NiCl2+2e-=Ni+2Cl-,钠离子向正极移动.
解答:解:A.负极上电极反应式为:Na-e-=Na+,正极上电极反应式为:NiCl2+2e-=Ni+2Cl-,所以该原电池中有氯化钠生成,故A正确;
B.根据正负极电极反应式知,金属钠还原NiCl2,故B错误;
C.正极上得电子发生还原反应,电极反应式为:NiCl2+2e-=Ni+2Cl-,故C正确;
D.原电池放电时,阳离子向正极移动,钠离子在负极产生,向正极移动,所以钠离子通过钠离子导体在两电极间移动,故D正确;
故选B.
B.根据正负极电极反应式知,金属钠还原NiCl2,故B错误;
C.正极上得电子发生还原反应,电极反应式为:NiCl2+2e-=Ni+2Cl-,故C正确;
D.原电池放电时,阳离子向正极移动,钠离子在负极产生,向正极移动,所以钠离子通过钠离子导体在两电极间移动,故D正确;
故选B.
点评:本题考查原电池原理,明确正负极上得失电子、离子的移动方向即可分析解答,难点是电极反应式的书写,难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目



