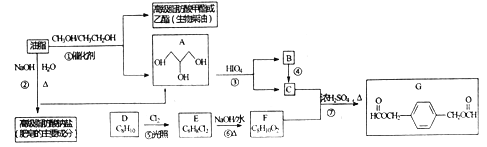
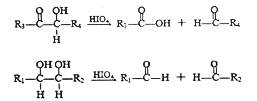
题目内容
【题目】按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因 。
(2)用离子方程式表示出泡沫灭火器的原理 。
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中离子浓度由大到小的顺序为 。
(4)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol· L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2
(5)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
若向该溶液中滴加NaOH溶液,则先沉淀的是 (填离子符号),
判断Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH= 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
【答案】(14分)(1)Fe3++3H2O![]() Fe(OH)3(OH)3+3H+(2分)
Fe(OH)3(OH)3+3H+(2分)
(2)Al3++3HCO3-=Al(OH)3↓+3CO2↑(2分)
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分)
(4)①A(2分)②AB(2分)(5)①Cu2+(1分)②<(1分)③6.7(2分)
【解析】
试题分析:(1)因Fe3+极易发生水解,水解反应式为Fe3++3H2O ![]() Fe (OH)3 (OH)3 +3H+ ,故配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释;
Fe (OH)3 (OH)3 +3H+ ,故配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释;
(2)泡沫灭火器的原理是利用Al3+和+3HCO3- 发生双水解反应,反应离子方程式为Al3+ +3HCO3- = Al(OH)3↓+3CO2↑;
(3)300mL 1molL-1的NaOH的物质的量=1mol/L×0.3L=0.3mol,标准状况下4.48LCO2的物质的量=![]() =0.2mol,所以氢氧化钠和二氧化碳反应方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即C(OH-)>C(H+),碳酸根离子水解生成碳酸氢根离子,所以C(HCO3-)>C(CO32-),由于水解程度较小,所以C(CO32-)>C(OH-),故溶液中各离子浓度大小顺序是C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+);
=0.2mol,所以氢氧化钠和二氧化碳反应方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即C(OH-)>C(H+),碳酸根离子水解生成碳酸氢根离子,所以C(HCO3-)>C(CO32-),由于水解程度较小,所以C(CO32-)>C(OH-),故溶液中各离子浓度大小顺序是C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+);
(4)①加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越弱,酸的PH变化越小,酸性最弱的酸是HCN,则pH变化最小的是HCN,故选A;
②HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,根据强酸制取弱酸知;A.酸性CH3COOH>H2CO3>HCO3-,所以二者反应为CH3COOH+Na2CO3═NaHCO3+CH3COONa,故正确;B.醋酸酸性大于HCN,所以二者反应为CH3COOH+NaCN═CH3COONa+HCN,故正确;C.碳酸酸性大于次氯酸,所以二者反应为CO2+H2O+NaClO═NaHCO3+NaClO,故错误;D.酸性H2CO3>HClO>HCN,所以NaHCO3、HCN二者不反应,故错误;故选AB;
(5)①Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;
②Mg2+、Fe2+开始沉淀的C(OH-)分别为:10-3.6molL-1、10-6.4molL-1,所以KSP[(Fe(OH)2]<KSP[(Mg(OH)2];
③溶液中Cu2+沉淀完全时其浓度小于1×10-5mol/L,则Ksp[Cu(OH)2]=c2(OH-)×c(Cu2+)=2.5×10-20,解得c(OH-)=5×10-8mol/L,此时溶液中c(H+)=Kw÷c(OH-)=2×10-7mol/L,pH=7-lg2=6.7。

【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:
(1)写出实验室制取W2反应的离子方程式: 。
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质。
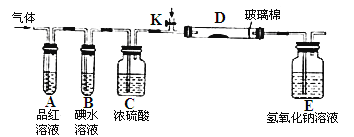
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为 。
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量 (填字母)可以看到白色沉淀生成。
A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式: 。