题目内容
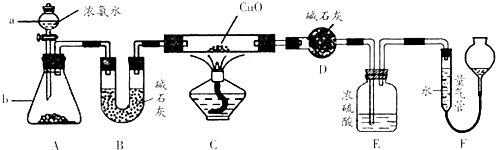
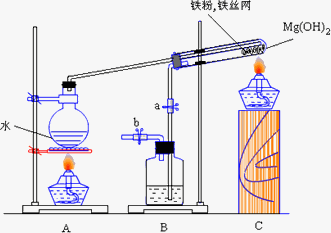
某课外研究小组,利用下列实验装置来完成“铁与水蒸气的反应”的实验,并检验气体产物。大试管中盛放是:
(1)Mg(OH)2 ,在受热分解后能产生350℃的水蒸气,使得反应获得足够高的热量;
(2)铁粉和铁丝网,铁丝网的作用是为了加大铁粉与水蒸气的接触面,并加大传热的效率。该实验能加快反应的速率,提高实验的成功率。
(1)Mg(OH)2 ,在受热分解后能产生350℃的水蒸气,使得反应获得足够高的热量;
(2)铁粉和铁丝网,铁丝网的作用是为了加大铁粉与水蒸气的接触面,并加大传热的效率。该实验能加快反应的速率,提高实验的成功率。

请你回答下列问题:
(1)写出铁与水蒸气反应的化学方程式______________。
(2)装置B中盛放的是___________,其作用是_____________。
(3)在实验进行前必须进行的操作是____________;为了检验导管口b处的气体,在检验前必须进行的操作是__________;
(4)实验完毕后的操作是____________。
(1)写出铁与水蒸气反应的化学方程式______________。
(2)装置B中盛放的是___________,其作用是_____________。
(3)在实验进行前必须进行的操作是____________;为了检验导管口b处的气体,在检验前必须进行的操作是__________;
(4)实验完毕后的操作是____________。
(1)3Fe+4H2O(g) Fe3O4 +4H2 ↑
Fe3O4 +4H2 ↑
(2)浓硫酸;干燥氢气
(3)装置的气密性检查;检验氢气的纯度。
(4)先熄灭A处酒精灯,然后关闭止水夹a,最后熄灭C处酒精灯。
 Fe3O4 +4H2 ↑
Fe3O4 +4H2 ↑(2)浓硫酸;干燥氢气
(3)装置的气密性检查;检验氢气的纯度。
(4)先熄灭A处酒精灯,然后关闭止水夹a,最后熄灭C处酒精灯。

练习册系列答案
相关题目
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用.某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量.设计的流程如图1:
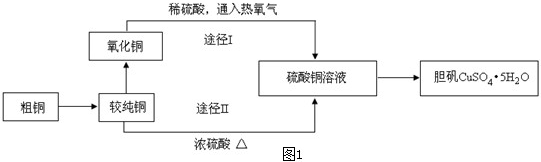
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称).“粗铜”表面的油脂可以用热碱溶液洗去,原因是 .若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜.存在少量铜的可能原因是 .
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥.比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:① ;② .
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是 .
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
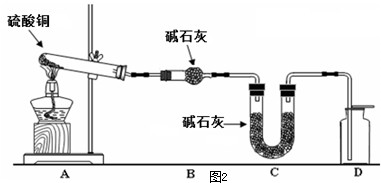
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: .

(1)“较纯铜”转化为氧化铜时,应将其置于
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 50.0g | 70.0g | 540.0g |
| 反应后 | 45.0g | 74.5g | 540.0g |

请通过计算,推断该实验条件下硫酸铜分解的化学方程式: