题目内容
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,又名“大苏打”,是无色单斜晶体。易溶于水,不溶于乙醇,具有较强的还原性,广泛地应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O属于______(填“纯净物”或“混合物”)。
(2)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_____。
(3)亚硫酸法制备Na2S2O3·5H2O简易流程如下:
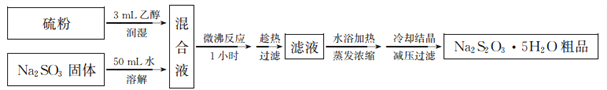
①Na2S2O3·5H2O制备原理为_________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;将白色沉淀过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量____(填试剂名称),若_______________(填现象),则证明产品中含有Na2SO3和Na2SO4(已知:Na2S2O3稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250 ml.的溶液待用。另取25 ml.0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________。已知Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、I2+2S2O32- =2I-+S4O62-。
【答案】 纯净物 S2O32-+2H+=S↓+SO2↑+H2O Na2SO3+S+5H2O=Na2S2O3·5H2O 稀盐酸 沉淀未完全溶解,并有刺激性气味的气体生成 62%
【解析】(1)Na2S2O3·5H2O属于纯净物。
(2)酸性条件下,S2O32-自身发生氧化还原反应生成SO2,所以Na2S2O3与盐酸反应生成SO2、S、氯化钠和水等,离子方程式为S2O32-+2H+=S↓+SO2↑+H2O。
(3)①由流程可知,Na2S2O3·5H2O制备原理为Na2SO3+S+5H2O=Na2S2O3·5H2O。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,因为Na2S2O3稀溶液与BaCl2溶液混合后无沉淀生成,而Na2SO3、Na2SO4都可以与BaCl2溶液反应,分别生成亚硫酸钡和硫酸钡沉淀,亚硫酸钡可以溶于盐酸生成有刺激性气味的二氧化硫气体,所以其检验步骤可以设计为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;将白色沉淀过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体生成,则证明产品中含有Na2SO3和Na2SO4 。
③由粗品中Na2S2O3·5H2O的质量分数的测定步骤及相关的反应可以得到关系式:Cr2O72-~3I2~6S2O32,所以n(Na2S2O3·5H2O)=n(S2O32)=6n(Cr2O72-)=6![]() 25
25![]() L
L![]() .0.01 mol/L=1.5
.0.01 mol/L=1.5![]() mol,则6g粗品中Na2S2O3·5H2O的质量为
mol,则6g粗品中Na2S2O3·5H2O的质量为![]() 1.5
1.5![]() mol
mol![]() 248g/mol=3.72g,粗品中Na2S2O3·5H2O的质量分数为
248g/mol=3.72g,粗品中Na2S2O3·5H2O的质量分数为![]() =62% .
=62% .