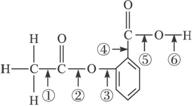
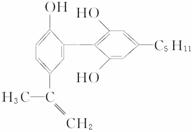
题目内容
由相同条件下的三个反应:①2A-+B2→2B-+A2 ②2C-+A2→2A-+C2③2B-+D2→2D-+B2,由此可以判断( )
| A、氧化性:A2>B2>C2>D2 | B、还原性:C->A->B->D- | C、反应2A-+D2→2D-+A2不能进行 | D、反应2C-+B2→2B-+C2不能进行 |
分析:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物;氧化性强的物质易于还原性强的物质反应.
解答:解:AB.根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性来判断,那么氧化性D2>B2>A2>C2,还原性C->A->B->D-,故A错误,B正确.
CD.根据氧化性强的物质易于还原性强的物质反应,氧化性:D2>A2>,还原性:A->D-,故A-和D2能反应;同理B2和C-可以进行反应,故C、D错误;
故选B.
CD.根据氧化性强的物质易于还原性强的物质反应,氧化性:D2>A2>,还原性:A->D-,故A-和D2能反应;同理B2和C-可以进行反应,故C、D错误;
故选B.
点评:本题考查了氧化性强弱比较和还原性强弱比较,以及利用强弱关系判断离子方程式正误,题目比较基础.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
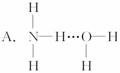
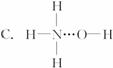
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)
4R(s)+2Z3(g)
则16g Z2(g)完全转化为Z3(g)的△H= .


 的沸点高于
的沸点高于