题目内容
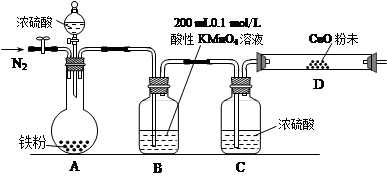
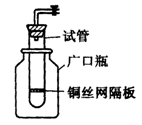
(11分)(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。
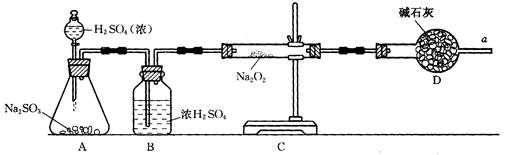
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。

(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。

装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
| A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧. |
| B.将C装置中反应后的固体物质溶于适量水配成溶液. |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成. |
| D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
(11分)(除方程式,每空1分)
(1)H2 CO2 H2S , H2 2Al+2OH-+2H2O==2AlO2-+3H2↑(2分)
(2)① 2CO2+2Na2O2==2Na2CO3+O2(2分)
②是,由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠。
③B装置用于干燥SO2气体,防止水蒸气进入C装置与Na2O2反应。 D装置是为了防止空气中的水蒸气、CO2进入C装置与Na2O2反应生成氧气,同时吸收过量SO2气体,便于氧气的检验和防止污染空气
④A、B、D
(1)H2 CO2 H2S , H2 2Al+2OH-+2H2O==2AlO2-+3H2↑(2分)
(2)① 2CO2+2Na2O2==2Na2CO3+O2(2分)
②是,由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠。
③B装置用于干燥SO2气体,防止水蒸气进入C装置与Na2O2反应。 D装置是为了防止空气中的水蒸气、CO2进入C装置与Na2O2反应生成氧气,同时吸收过量SO2气体,便于氧气的检验和防止污染空气
④A、B、D
(1)固液不加热可制取的气体共三种:H2、CO2 、H2S。而制后两种气体进均需用到酸,所以改用铁丝网时就不能制取了,只能换作碱性溶液和铝来制取的氢气了。
(2)④检验是否有氧气的生成一般用带火星的木条。检验SO42—的存在一般是先加入盐酸,再加入氯化钡溶液,观察是否有沉淀生成
(2)④检验是否有氧气的生成一般用带火星的木条。检验SO42—的存在一般是先加入盐酸,再加入氯化钡溶液,观察是否有沉淀生成

练习册系列答案
相关题目