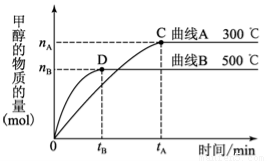
题目内容
(8分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。
则表示甲醇燃烧热的热化学方程式为_____________________________________;
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。______________________________;
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量_________________________________。
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为 。
(1) CH3OH(l)+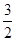 O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
(2)N2(g)+2O2(g)=2NO2(g) ΔH=67.8kJ·mol-1
(3)C2H2(g)+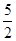 O2(g) →2CO2(g)+H2O(l) ΔH=–1300kJ·mol-1
O2(g) →2CO2(g)+H2O(l) ΔH=–1300kJ·mol-1
(4)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);DH=-1136kJ/mol
解析

练习册系列答案
相关题目