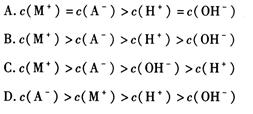题目内容
今有室温下四种溶液,有关叙述不正确的是
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va∶Vb=11∶9
C
解析试题分析:A、已知醋酸铵溶液呈中性,这说明醋酸和氨水的电离程度是相同的。在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,NH4+结合OH-生成难电离的一水合氨,OH-浓度降低,两溶液的pH均减小,A正确;B、氢氧化钠和氯化氢是强电解质,完全电离。醋酸和氨水是弱酸与弱碱,存在电离平衡,稀释促进电离,则四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③,B正确;C、氨水是弱碱,pH=11的氨水溶液浓度大于0.001mol/L,则①、④两溶液等体积混合,氨水过量,溶液显碱性,则所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),C不正确;D、VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4,这说明盐酸过量,则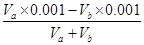 =0.0001,解得Va∶Vb=11∶9,D正确,答案选C。
=0.0001,解得Va∶Vb=11∶9,D正确,答案选C。
考点:考查弱电解质的电离、盐类水解、溶液稀释以及pH的计算

练习册系列答案
相关题目
将标准状况下1.12L氨气溶于500mL水中配制成溶液,从中取出5mL,有关这5mL溶液的叙 述正确的是
| A.溶液中c(NH4+)< c(OH—) | B.氨水的物质的量浓度为0.1 mol·L—1 |
| C.溶液的pH>13 | D.与5mL 0.1mol·L—1HCl溶液恰好完全中和 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D.浓度均为0.1 mol·L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③>②>① |
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
| A.Na2CO3 NaHCO3 NaCl NH4Cl | B.Na2CO3 NaHCO3 NH4Cl NaCl |
| C.(NH4)2SO4 NH4Cl NaNO3 Na2S | D.NH4Cl (NH4)2SO4 Na2S NaNO3 |
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的
量浓度均为0.1mol·L?1,下列说法正确的是
| A.四种溶液的pH的大小顺序:①>④>③>② |
| B.将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3·H2O) |
| C.向溶液①、②中分别滴加25mL 0.1mol·L?1盐酸后,溶液中c(NH4+):①<② |
| D.将溶液③、④等体积混合所得溶液中:2c(OH?)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32?) |
在一定条件下,Na2CO3溶液中存在CO32-+H2O HCO3-+OH-平衡。下列说法不正确的是( )
HCO3-+OH-平衡。下列说法不正确的是( )
A.稀释溶液, 减小 减小 | B.加入NaOH固体, 减小 减小 |
| C.升高温度,平衡常数增大 | D.通入CO2,溶液pH减小 |
下列溶液中各微粒的浓度关系正确的是
| A.pH=4的盐酸中:c(H+)=4.0mol·L-1 |
| B.NH4Cl溶液中:c(Cl-)=c(NH4+) |
| C.NaCl溶液中:c(Na+) + c(H+)= c(Cl-)+c(OH-) |
| D.NaHCO3溶液中:c(HCO3-)+c(H2CO3)+ c(CO32-) =c(Na+) |