题目内容
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小;用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为:____________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是:____________________________。
(3)可用于测定TiO2粒子大小的方法是____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_________(填字母代号)。

(5)滴定时,称取TiO2(摩尔质量为Mg·mol-1)试样wg,消耗cmol·L-1NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为____________。
(6)判断下列操作对配制NH4Fe(SO4)2标准溶液的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,将导致结果______。
②若定容时俯视容量瓶刻线,将导致结果_____________。
【答案】 TiCl4+(x+2)H2O=TiO2·xH2O+4HCl 取洗涤后溶液,滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,说明Cl-已经洗干净了 d ac cVM/1000w 偏低 偏高
【解析】(1)由题意知,TiCl4水解生成TiO2·xH2O的化学方程式为:TiCl4+(x+2)H2O=TiO2·xH2O+4HCl 。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是:取洗涤后溶液,滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,说明Cl-已经洗干净了。
(3) a.核磁共振法可用于测定有机物中氢原子的种类;b.红外光谱法可用于测定有机物分子中的基团种类;c.质谱法可用于测定相对分子质量;可用于测定TiO2粒子大小的方法是d.透射电子显微镜法。
(4)配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的a(容量瓶)和c(胶头滴管)。
(5)滴定时,称取TiO2(摩尔质量为Mg·mol-1)试样wg,消耗cmol·L-1NH4Fe(SO4)2标准溶液VmL,由滴定原理Ti3++Fe3+=Ti4++Fe2+知,n(TiO2)=n[NH4Fe(SO4)2]=V![]() L
L![]() cmol·L-1,则TiO2质量分数表达式为cVM/1000w。
cmol·L-1,则TiO2质量分数表达式为cVM/1000w。
(6)①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,则有少量溶质损失,将导致结果偏低。
②若定容时俯视容量瓶刻线,则所配溶液体积偏小,将导致结果偏高。

【题目】澳大利亚开发的质子流电池系统如图所示。下列说法正确的是
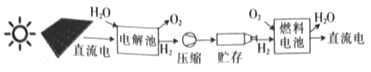
A. 电能是一次能源
B. 太阳能电池的供电原理与燃料电池相同
C. 图中能量转化方式只有2种
D. 燃料电池中的总反应为2H2+O2=2H2O
