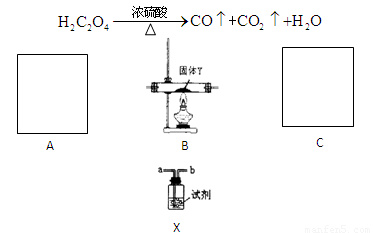
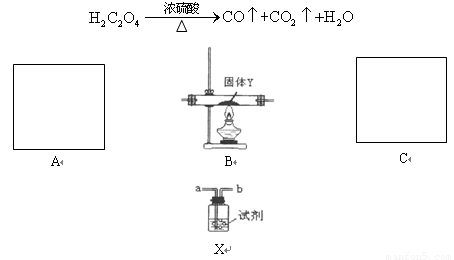
题目内容
为了证明CO具有还原性,有人设计了如下图所示的实验。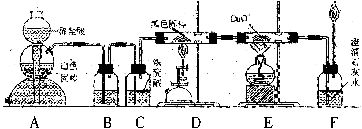
(1)装置B中最适宜的试剂是________________。
(2)装置D中发生反应的化学方程式为____________________。
(3)必须用装置C吸收气体中的水蒸气的理由是___________________________________。
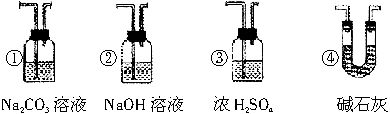
(4)若想根据装置F中石灰水变浑浊的现象来确认CO具有还原性,应在上图中的装置_______(选填装置的字母代号,下同)与装置__________之间连接下图中的______(选填序号①、②、③、④)装置。
(1)饱和NaHCO3溶液;
(2)C+CO2 2CO;
2CO;
(3)湿润的CO2气体进入装置D中,水蒸气与碳在高温下发生反应后生成物中有H2,H2也能还原CuO,对证明CO具有还原性这个实验有严重的干扰;
(4)D; E; ④
【试题分析】
解析:装置A是CO2气体的发生装置,使用的白色固体应是CaCO3(通常不用Na2CO3固体,一方面是因为碳酸钠易溶于水,另一方面是因为碳酸钠与盐酸反应过于剧烈,不便于产生平稳的CO2气流),与稀盐酸反应生成CO2气体。因为盐酸具有挥发性,所以在制得的CO2气体中会混有一定量的HCl气体,要除去杂质HCl气体,B瓶中应盛饱和NaHCO3溶液(特别指出,B瓶中不能盛饱和Na2CO3溶液,因为会发生反应Na2CO3+CO2+H2O=2NaHCO3)。
C瓶中的浓硫酸是用来除去混在CO2气体中的水蒸气的,如果水蒸气不除去,就会与D管中的单质碳发生反应(俗称水煤气反应,其化学方程式为C+H2O CO+H2,CO+H2O
CO+H2,CO+H2O CO2+H2),反应生成的H2也能还原CuO,H2的存在对验证CO具有还原性的实验有严重的干扰。
CO2+H2),反应生成的H2也能还原CuO,H2的存在对验证CO具有还原性的实验有严重的干扰。
如果要想根据装置F中澄清石灰水变浑浊的现象来确认CO具有还原性,就必须除去D管中导出的CO气体中混有的CO2(来自装置A的未参加反应的CO2),应该在D和E之间增加一个装置,这个装置内所盛的试剂既要能吸收CO2(浓硫酸不能吸收CO2,可排除③),又不能带入水蒸气(因为冷的湿润的气体导入后面E中红热的玻璃管中,可能会导致玻璃管炸裂),据此可以排除①和②,选④。
装置E用酒精灯加热(温度相对较低),装置D用酒精喷灯加热(温度高),在书写装置D中发生反应的化学方程式时,不宜用加热符号“△”,应该注明反应条件是“高温”。

练习册系列答案
相关题目