题目内容
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)
在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g)
在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g) 2SO3(g)
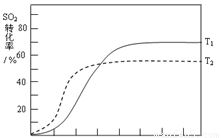
△H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g)
△H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。

(1)4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
(2)K=1.6×103 (2分) 80% (2分) (3)B(1分,多选不得分)
【解析】
试题分析:(1)FeS2完全燃烧燃烧的化学方程式是4FeS2+11O2 2Fe2O3+8SO2,由于1g FeS2完全燃烧放出7.1kJ热量,则4molFeS2完全燃烧放出的热量是7.1kJ×120×4=3408kJ,所以该反应的热化学方程式是4FeS2(s)+11O2(g)
2Fe2O3+8SO2,由于1g FeS2完全燃烧放出7.1kJ热量,则4molFeS2完全燃烧放出的热量是7.1kJ×120×4=3408kJ,所以该反应的热化学方程式是4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
(2)
2SO2(g)+O2(g)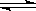 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.050 0.030 0
转化浓度(mol/L) 0.040 0.020 0.040
平衡浓度(mol/L) 0.010 0.010 0.040
所以该温度下平衡常数K=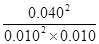 =1600
=1600
SO2的平衡转化率=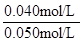 ×100%=80%
×100%=80%
(3)向平衡混合物中充入Ar,容器容积不变,浓度不变,反应速率和平衡状态不变,A不正确;向平衡混合物中充入O2,增大反应物的浓度,反应速率增大,平衡向正反应方向移动,B正确;改变反应的催化剂平衡状态不变,C不正确;降低反应的温度,平衡向正反应方向移动,但反应速率降低,D不正确,答案选B。
(4)温度高反应速率快,到达平衡的时间减少。由于正反应是放热反应,所以温度高不利于平衡向正反应方向进行,SO2的转化率降低,因此正确的图像是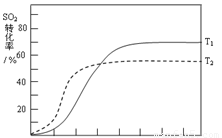 。
。
考点:考查热化学方程式的书写、平衡常数和转化率的计算、外界条件对反应速率和平衡状态的判断以及可逆反应图像的分析和判断
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
| |||||||||||||||||||
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。