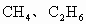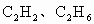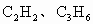题目内容
20mL由两种气态烃组成的混合物,和足量的O2完全燃烧生成了30mL水蒸气和40mL CO2(在同温同压下测定),该混合物可能由下列两种烃组成的是( )
分析:烃完全燃烧生成二氧化碳和水,结合水、二氧化碳的体积,根据H原子、C原子守恒,计算烃的平均分子组成,据此判断.
解答:解:20mL由两种气态烃组成的混合物,和足量的O2完全燃烧生成了30mL水蒸气和40mL CO2(在同温同压下测定),
令平均分子组成为CxHy,则:
由碳原子守恒,20x=40×1,解得x=2.
由氢原子守恒,20y=30×2,解得y=3.
所以平均分子组成为C2H3.
A、若C2H2和C2H4,由碳原子可知为二者为任意比混合,其平均分子组成中H原子数目为3,由氢原子可知二者为1:1混合,故A正确;
B、若C2H4、C2H6,平均H原子数介于4~6之间,大于平均分子组成中H原子数目3,故不可能,故B错误;
C、若CH4、C2H2,平均C原子数介于1~2之间,小于平均分子组成中C原子数目2,故不可能,故C错误;
D、若C2H4、C3H8,平均C原子数介于2~3之间,大于平均分子组成中C原子数目2,故不可能,故D错误.
故选:A.
令平均分子组成为CxHy,则:
由碳原子守恒,20x=40×1,解得x=2.
由氢原子守恒,20y=30×2,解得y=3.
所以平均分子组成为C2H3.
A、若C2H2和C2H4,由碳原子可知为二者为任意比混合,其平均分子组成中H原子数目为3,由氢原子可知二者为1:1混合,故A正确;
B、若C2H4、C2H6,平均H原子数介于4~6之间,大于平均分子组成中H原子数目3,故不可能,故B错误;
C、若CH4、C2H2,平均C原子数介于1~2之间,小于平均分子组成中C原子数目2,故不可能,故C错误;
D、若C2H4、C3H8,平均C原子数介于2~3之间,大于平均分子组成中C原子数目2,故不可能,故D错误.
故选:A.
点评:考查烃混合物分子式确定,难度较大,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
相关题目