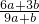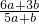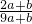题目内容
(1)我国实施的“南水北调”工程是为了解决北方地区长期缺水的状况,进而发生若干复分解反应,在沉降池中所得沉淀的主要成分是______和______(填化学式)
(2)工业生产中FeSO4?7H2O是常用的混凝剂.实验应用时必须将Fe2+氧化成Fe3+,在溶液中生成Fe(OH)3,起到较好的混凝作用.FeSO4?7H2O混凝剂除去悬浮固体颗粒起到净水作用的过程中______(填编号)
①发生水解 ②发生氧化还原反应 ③发生胶体的聚沉
(3)净化后的水要进一步消毒,常用的消毒剂是Cl2.Cl2消毒的实质是Cl2和水反应生成了______(填化学式),Cl2与水反应的离子方程式为______.
解:(1)硬水中所含有较多Ca2+,Mg2+,HCO3-等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,使钙离子和镁离子沉淀析出,在沉降池中的主要成分是(CaCO3)和(Mg(OH)2),故答案为:CaCO3;Mg(OH)2;
(2)工业生产中FeSO4?7H2O是常用的混凝剂.实验应用时必须将Fe2+氧化成Fe3+,在溶液中生成Fe(OH)3,起到较好的混凝作用.FeSO4?7H2O混凝剂除去悬浮固体颗粒起到净水作用的过程中含有Fe2+氧化成Fe3+发生氧化还原反应;在溶液中生成Fe(OH)3三价铁离子发生水解反应;氢氧化铁胶体起到较好的混凝作用,是胶体的性质聚沉,故答案为:①②③;
(3)净化后的水要进一步消毒,常用的消毒剂是Cl2.Cl2消毒的实质是Cl2和水反应生成了次氯酸,发生反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:HClO;Cl2+H2O=H++Cl-+HClO.
分析:(1)将硬水中所含有较多Ca2+,Mg2+,HCO3-等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,在沉降池中的主要成分是(CaCO3)和(Mg(OH)2);
(2)将Fe2+氧化成Fe3+,在溶液中生成Fe(OH)3,起到较好的混凝作用,分别发生氧化还原反应、盐类水解反应、胶体聚沉;
(3)净化后的水要进一步消毒,常用的消毒剂是Cl2,原理是氯气和水反应产生次氯酸具有强氧化性,起到杀菌消毒作用.
点评:本题考查了硬水软化的方法和反应,混凝剂的作用原理和反应过程,氯气的杀菌消毒作用的原因分析,较简单.
(2)工业生产中FeSO4?7H2O是常用的混凝剂.实验应用时必须将Fe2+氧化成Fe3+,在溶液中生成Fe(OH)3,起到较好的混凝作用.FeSO4?7H2O混凝剂除去悬浮固体颗粒起到净水作用的过程中含有Fe2+氧化成Fe3+发生氧化还原反应;在溶液中生成Fe(OH)3三价铁离子发生水解反应;氢氧化铁胶体起到较好的混凝作用,是胶体的性质聚沉,故答案为:①②③;
(3)净化后的水要进一步消毒,常用的消毒剂是Cl2.Cl2消毒的实质是Cl2和水反应生成了次氯酸,发生反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:HClO;Cl2+H2O=H++Cl-+HClO.
分析:(1)将硬水中所含有较多Ca2+,Mg2+,HCO3-等除去的方法是加入生石灰生成Ca(OH)2,进而发生若干复分解反应,在沉降池中的主要成分是(CaCO3)和(Mg(OH)2);
(2)将Fe2+氧化成Fe3+,在溶液中生成Fe(OH)3,起到较好的混凝作用,分别发生氧化还原反应、盐类水解反应、胶体聚沉;
(3)净化后的水要进一步消毒,常用的消毒剂是Cl2,原理是氯气和水反应产生次氯酸具有强氧化性,起到杀菌消毒作用.
点评:本题考查了硬水软化的方法和反应,混凝剂的作用原理和反应过程,氯气的杀菌消毒作用的原因分析,较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖 | 51.3 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)在用托盘天平称量蔗糖时,若将蔗糖放在了右盘,50g砝码放在了左盘,调节游码1.3g,则实际称量所得蔗糖质量为______.
(3)配制该1L“鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有______.(在横线上填写所缺仪器的名称)
(4)在配制溶液时,玻璃棒有两种不同的用途,分别是______、______.