题目内容
某实验小组欲利用该黑色粉末(氧化铜和氧化亚铁的混合物)制取较纯净的硫酸铜,通过查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的PH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
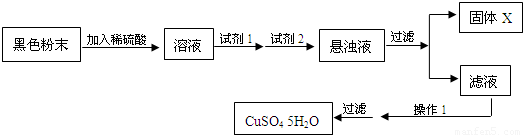
试回答:
试剂1为 ,试剂2为 (填字母),固体X的化学式是 ;
操作1中各步骤的名称为 .
【答案】分析:根据表中数据可知,Fe(OH)3溶解度较小,为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,调节溶液PH的物质应为Cu2(OH)2CO3,当调节溶液的PH为3.7时,
Fe(OH)3沉淀完全,过滤除去,滤液为硫酸铜溶液,经蒸发、冷却、结晶而得到晶体.
解答:解:根据表中数据可知,除去Cu2+离子中的Fe2+离子,应先加入氧化剂将Fe2+离子氧化为Fe3+离子,因 Fe(OH)3溶解度较小,如不加入氧化剂氧化,调节溶液pH后易生成Cu(0H)2沉淀而难以除去Fe2+离子,为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,调节溶液PH的物质应为Cu2(OH)2CO3,当调节溶液的PH为3.7时,Fe(OH)3沉淀完全,过滤除去,滤液为硫酸铜溶液,经蒸发、冷却、结晶而得到晶体.
故答案为:B;D;Fe(OH)3;蒸发、降温、结晶.
点评:本题考查物质的制备和除杂等问题,题目难度不大,做题注意不能引入新的杂质,从这一点考虑选取氧化剂和除杂试剂.
Fe(OH)3沉淀完全,过滤除去,滤液为硫酸铜溶液,经蒸发、冷却、结晶而得到晶体.
解答:解:根据表中数据可知,除去Cu2+离子中的Fe2+离子,应先加入氧化剂将Fe2+离子氧化为Fe3+离子,因 Fe(OH)3溶解度较小,如不加入氧化剂氧化,调节溶液pH后易生成Cu(0H)2沉淀而难以除去Fe2+离子,为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,调节溶液PH的物质应为Cu2(OH)2CO3,当调节溶液的PH为3.7时,Fe(OH)3沉淀完全,过滤除去,滤液为硫酸铜溶液,经蒸发、冷却、结晶而得到晶体.
故答案为:B;D;Fe(OH)3;蒸发、降温、结晶.
点评:本题考查物质的制备和除杂等问题,题目难度不大,做题注意不能引入新的杂质,从这一点考虑选取氧化剂和除杂试剂.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
 2NH3 + 3CuO
2NH3 + 3CuO