题目内容
当燃烧8.96升由CH4、CO、C2H6组成的混和气体时,除生成水外,还生成13.44升CO2气体(气体体积均在标准状况下测定)。则原混和气体中含C2H6的物质的量是( )
| A.0.2mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
A
1分子的CH4与CO完全燃烧都是生成1分子的二氧化碳,1分子的乙烷完全燃烧得到2分子二氧化碳,,由此,可以把CH4、CO看作一种气体X,则又二者体积之和为8.96L,则V(X)+ V(C2H6) = 8.96L,(1)
再由二者完全燃烧得到的二氧化碳为13.44L,则:
V(X)+ 2V(C2H6) = 13.44L。(2)
由(1)、(2)计算可得:V(C2H6) = 4.48L,故n(C2H6)="0.2" mol。
再由二者完全燃烧得到的二氧化碳为13.44L,则:
V(X)+ 2V(C2H6) = 13.44L。(2)
由(1)、(2)计算可得:V(C2H6) = 4.48L,故n(C2H6)="0.2" mol。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
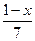
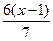
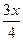
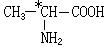 有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如
有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如 ①标出下列有机物X中的手性碳原子:
①标出下列有机物X中的手性碳原子: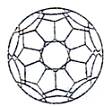 第(3)小题中的Cx也是其中一种富勒烯,则第(3)小题Cx结构中五边形和六边形的个数分别是____________和 。(提示:欧拉定理:顶点数+面数-棱数=2)
第(3)小题中的Cx也是其中一种富勒烯,则第(3)小题Cx结构中五边形和六边形的个数分别是____________和 。(提示:欧拉定理:顶点数+面数-棱数=2)