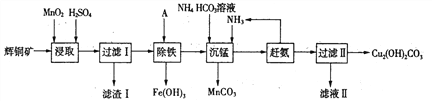
题目内容
【题目】某同学进行实验研究时,需要配制450mL 0.1 mol·L-1 Na2CO3溶液。
(1)经过计算,使用托盘天平应该称量__________g Na2CO3固体;
(2)配制溶液时,除了托盘天平、药匙 、量筒、烧杯、玻璃棒外,还需要的仪器有______________________________________________________;
(3)配制溶液时,需经过称量、溶解、转移溶液、_________、定容、摇匀等操作。下列图示对应的操作规范的一个是____________;


![]()
![]()
A.称量 B.溶解 C.转移 D.定容
(4)误差分析:若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度____________;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,则所配溶液的浓度_________________。(填偏高、偏低、无影响)
【答案】 5.3g 500mL容量瓶、 胶头滴管 洗液(洗涤) B 无影响 偏低
【解析】(1)应该用500mL容量瓶,则使用托盘天平应该称量0.5L×0.1mol/L×106g/mol=5.3g Na2CO3固体;(2)配制溶液时,除了托盘天平、药匙、量筒、烧杯、玻璃棒外,还需要的仪器有500mL容量瓶、胶头滴管(定容时需要);(3)配制溶液时,需经过称量、溶解、冷却、转移溶液、洗涤、振荡、定容、摇匀等操作。A.称量时应该左物右码,A错误;B.溶解在烧杯中进行,用玻璃棒搅拌,B正确;C.转移需要玻璃棒引流,C错误;D.定容时胶头滴管不能插入容量瓶中,D错误,答案选B。(4)若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度无影响;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,导致溶液体积增加,则所配溶液的浓度偏低。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案