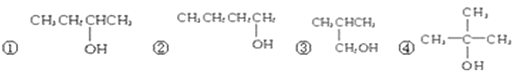
题目内容
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示: Fe2+ ![]() Fe3+
Fe3+ ![]() FeO42﹣(高铁酸根离子)
FeO42﹣(高铁酸根离子)
I.回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm.
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板.写出FeCl3溶液腐蚀铜的化学反应方程式: . 检验反应后溶液中还存在Fe3+ 的试剂是 .
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O还原剂是 , 生成1molNa2FeO4转移电子数目为 .
【答案】
(1)1~100
(2)2FeCl3+Cu═2 FeCl2+CuCl2; KSCN溶液
(3)Fe(OH)3;3NA
【解析】解:(1)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,生成氢氧化铁胶体,胶体的微粒直径的范围是1~100nm,所以答案是:1~100;(2)铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2 FeCl2+CuCl2,检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,该反应的离子方程式为Fe3++SCN﹣=[Fe(SCN)]2+,
所以答案是:2FeCl3+Cu═2 FeCl2+CuCl2;KSCN溶液;(3)反应2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O中,Fe元素化合价升高,氢氧化铁是还原剂,根据化合价规则,Na2FeO4中Fe是+6价,在反应中Na2FeO4是氧化产物,该反应中,化合价降低值=化合价升高值=转移电子数=6,所以每生成1mol Na2FeO4反应中转移电子的物质的量为3mol,
所以答案是:Fe(OH)3;3NA;

【题目】土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.某兴趣小组以黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示. 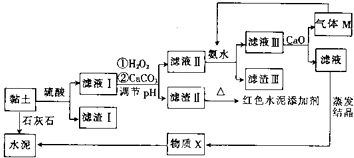
已知:黏土的主要成分为2CaO3Al2O3FeOFe2O310SiO2nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(1)为提高酸浸速率,除适当增大硫酸浓度外,还可采取的措施有(任写一条).
(2)向滤液Ⅰ中加入H2O2的作用是;用CaCO3调节溶液pH约为3.3,其目的是 .
(3)红色水泥添加剂的主要成分是 .
(4)物质X的化学式为 .
(5)气体M的电子式为;向滤液Ⅲ中加入CaO的作用是(任写一条).
(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3 ![]() Al2O3+3H2O、 .
Al2O3+3H2O、 .