题目内容
19.下列各组物质的性质及粒子的性质变化正确的是( )| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 酸性HClO4>H2SO4>H2CO3>HClO | D. | 离子半径Na+>F->O2->N3- |
分析 A.元素的非金属性越强,对应的氢化物越稳定;
B.卤素氢化物的酸性,随着卤素原子的原子序数的增大而增强;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.核外电子排布相同的离子,原子序数越大,离子半径越小.
解答 解:A.元素的非金属性越强,对应的氢化物越稳定,非金属性:Cl>Br>S,则HCl>HBr>H2S,而I与S的电负性相同,不能比较,故A错误;
B.卤素氢化物的酸性,随着卤素原子的原子序数的增大而增强,则酸性HF<HCl<HBr<HI,故B错误;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>S>C,则酸性HClO4>H2SO4>H2CO3,HClO不是最高价含氧酸是弱酸,则酸性HClO4>H2SO4>H2CO3>HClO,故C正确;
D.核外电子排布相同的离子,原子序数越大,离子半径越小,则离子半径Na+<F-<O2-<N3-,故D错误.
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
14.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 9g D216O所含的中子数为4.5 NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 1.6gNH2-离子所含质子数为NA |
4.下列现象中属于物理变化的是( )
| A. | 钢铁生锈 | B. | 煤的燃烧 | C. | 冰融化成水 | D. | 火药爆炸 |
11.下列各组名称中,表示同一种物质的组是( )
| A. | 水、冰、干冰 | B. | 胆矾、蓝矾、硫酸铜晶体 | ||
| C. | 烧碱、火碱、纯碱 | D. | 大理石、石灰石、生石灰 |
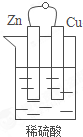 (1)如图原电池装置所示,请回答:
(1)如图原电池装置所示,请回答: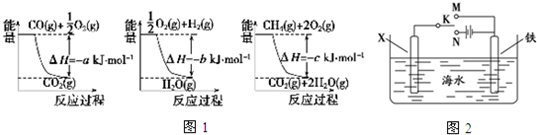
 ;
; .
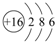
.