题目内容
在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 克固体。
(1)36.5% 11.8 mol·L-1 (2)1 mol·L-1 (3)2.6 (4)5.85
【解析】(1)n(HCl)= =10 mol,
=10 mol,
m(HCl)=10 mol×36.5 g·mol-1=365 g,
盐酸的质量分数w=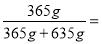 ×100%=36.5%,
×100%=36.5%,
c(HCl)=
=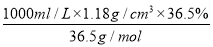
=11.8 mol·L-1。
(2)根据c(浓)·V(浓)=c(稀)·V(稀)
可知:c(稀)=11.8 mol·L-1×0.1 L/1.18 L=1 mol·L-1。
(3)n(Na2CO3)=0.040 L×0.065 mol·L-1
=0.002 6 mol,
设加入稀盐酸的体积最多不超过x mL,
则n(HCl)=1 mol·L-1×0.001x L=0.001x mol,
根据反应Na2CO3+HCl=NaHCO3+NaCl得0.002 6=0.001x,x=2.6。
(4)经过反应,蒸发中和后的溶液,最后所得固体为NaCl、根据Cl原子守恒:
n(NaCl)=n(HCl)=0.050 L×2 mol·L-1=0.1 mol,
m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。

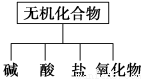
无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法是 。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式: 。
(4)呼吸面具中用⑧作为O2来源的反应原理为: 。
(5)实验室制备⑦常用 和 反应,检验该气体的方法是 。
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
