��Ŀ����
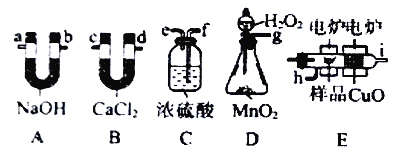
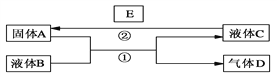
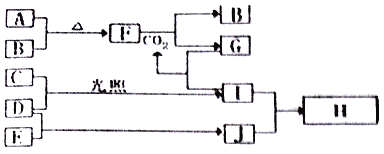
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯����(������Һ)��ת����ϵ����֪B��C��D��E�Ƿǽ������ʣ����ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬��
������������:
(1)F���еĻ�ѧ��Ϊ___��
(2)A-J�����ڹ��ۻ��������_____(�ѧʽ����ͬ)�������ӻ��������______��
(3)�������ϵͼ�ķ�Ӧ�У���Ҫ��д����ѧ����ʽ�������ӷ�Ӧ��ֻд�����ӷ���ʽ:�������Ӽ������ۼ��ƻ����������Ӽ�����۽����ɵĻ�ѧ��Ӧ______(�м���д����)��
(4)�õ���ʽ��ʾ��AԪ�غ�DԪ����ɵĻ�������γɹ���_______��H�ĵ���ʽΪ_____��
���𰸡� ���Ӽ����ۼ� HCl��NH3 Na2O2��Na2CO3��NH4Cl 2Na2O2+2CO2=2Na2CO3+O2��CO32-+2H+=CO2��+H2O ![]()
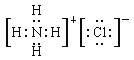
�����������⿼��������ƶϡ�C��D�ڹ����·�����Ӧ����������������Ƿǽ������ʣ��ɵö�����H2��Cl2����I��HCl��I��J��Ӧ�õ���ο�֪J��NH3��H��NH4Cl���Ӷ���ȷ��C��Cl2��D��H2��E��N2���ɻ�����G����ɫ��ӦΪ��ɫ����֪GΪ���Σ����������B�Ƿǽ������ʣ�����B��O2��A��Na����F��Na2O2��G��Na2CO3���ݴ˷������⡣
(1) ������Ϸ�����֪F��Na2O2���������ӻ�����������Ӽ����ۼ�����ȷ�𰸣����Ӽ����ۼ���
(2) ֻ���й��ۼ��Ļ�����Ϊ���ۻ�������A-J�����ڹ��ۻ��������HCl��NH3���������Ӽ��Ļ�����Ϊ���ӻ����A-J���������ӻ��������Na2O2��Na2CO3��NH4Cl����ȷ�𰸣�HCl��NH3��Na2O2��Na2CO3��NH4Cl��
(3) �������Ӽ������Լ����Ǽ��Լ��ƻ����������Ӽ������Լ����Ǽ��Լ����ɵĻ�ѧ��ӦΪ2Na2O2+2CO2![]() 2Na2CO3+O2�����������к������Ӽ��ͷǼ��Լ���������̼�к��м��Լ���̼�����к������Ӽ��ͼ��Լ��������к��зǼ��Լ����������ӷ�Ӧ�ķ�������ԭ��Ӧ��̼����������ķ�Ӧ����Ӧ�����ӷ���ʽΪ��CO32-+2H+=CO2��+H2O����ȷ�𰸣�2Na2O2+2CO2=2Na2CO3+O2��CO32-+2H+=CO2��+H2O��
2Na2CO3+O2�����������к������Ӽ��ͷǼ��Լ���������̼�к��м��Լ���̼�����к������Ӽ��ͼ��Լ��������к��зǼ��Լ����������ӷ�Ӧ�ķ�������ԭ��Ӧ��̼����������ķ�Ӧ����Ӧ�����ӷ���ʽΪ��CO32-+2H+=CO2��+H2O����ȷ�𰸣�2Na2O2+2CO2=2Na2CO3+O2��CO32-+2H+=CO2��+H2O��
(4)����������Ӧ�������ӻ������⻯�ƣ�����ʽ��ʾ��AԪ�غ�DԪ����ɵĻ�������γɹ���Ϊ��![]() ���������Ϸ�����֪��HΪ�Ȼ�泥��������ӻ��������ʽΪ��
���������Ϸ�����֪��HΪ�Ȼ�泥��������ӻ��������ʽΪ��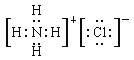 ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��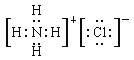 ��
��

����Ŀ����1����2L�����ܱ������У�������Ӧ2NO��g��+O2��g��2NO2��g����
��ij�¶�ʱ�������ʵ�����2��1����NO��O2��ʼ��Ӧ��n��NO����ʱ��仯�����
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0��4s����O2Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ________��
����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
A��������ɫ���ֲ��� B������ƽ����Է����������ֲ���
C��������NO��=2������O2�� D������ѹǿ���ֲ���
����֪��K300�棾K400�森���д�ʩ��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_______��
A�������¶� B������Arʹѹǿ����
C��ѡ���Ч���� D������NOʹѹǿ����
��2������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml 1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
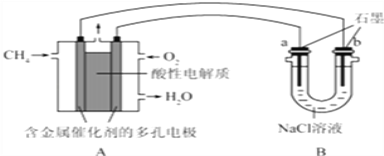
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��____________________________________________��
�ڵ�����Һ��pH=________����������������������Һ��Ӧ����
��3���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲���ͼ��Ȼ��ش����⣺

������3����Ӧ�з���ʾ��ͼ�����ķ�Ӧ���� ___________������ţ���
A��������Fe2O3��Ӧ B����ˮϡ��Ũ������Һ C�����ȵ�̼��CO2��Ӧ
���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4��g��+H2O��g��=CO��g��+3H2��g����H=+306kJ/mol
CH4��g��+CO2��g��=2CO��g��+2H2��g����H=+240kJ/mol
CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽΪ_______________________��