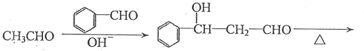
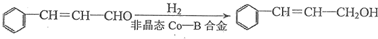题目内容
(2010?西城区一模)下列说法正确的是( )
分析:A、溶液中氧化性Fe3+>Cu2+,铁先和铁离子反应后再和铜离子反应,所以固体剩余一定含铜;
B、CO2和SO2混合气体通入BaCl2溶液中不反应,通入Ba(NO3)2溶液中,二氧化碳不反应,二氧化硫溶于水形成亚硫酸,溶液中硝酸根离子具有强氧化性能氧化亚硫酸;
C、依据检验氯离子和硫酸根离子的实验方法分析;
D、NH4Cl固体和Ca(OH)2固体的混合物加热发生反应;
B、CO2和SO2混合气体通入BaCl2溶液中不反应,通入Ba(NO3)2溶液中,二氧化碳不反应,二氧化硫溶于水形成亚硫酸,溶液中硝酸根离子具有强氧化性能氧化亚硫酸;
C、依据检验氯离子和硫酸根离子的实验方法分析;
D、NH4Cl固体和Ca(OH)2固体的混合物加热发生反应;
解答:解:A、将铁粉加入FeCl3、CuCl2混合溶液中,Fe先与Fe3+反应,再与Cu2+反应,如果反应有剩余,必定含有Cu,故A错误;
B、将CO2和SO2混合气体通入BaCl2溶液中,由于无法弱酸制强酸,因此反应不进行,通入Ba(NO3)2溶液中,由于HNO3可以把H2SO3氧化为H2SO4,因此有BaSO4沉淀生成,故B错误;
C、检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、若生成白色沉淀,说明含有硫酸根离子,加入AgNO3溶液生成白色沉淀说明含有氯离子,故C正确;
D、NH4Cl固体和Ca(OH)2固体的混合物加热,两者反应了生成NH3,而不是分离,故D错误;
故选C.
B、将CO2和SO2混合气体通入BaCl2溶液中,由于无法弱酸制强酸,因此反应不进行,通入Ba(NO3)2溶液中,由于HNO3可以把H2SO3氧化为H2SO4,因此有BaSO4沉淀生成,故B错误;
C、检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、若生成白色沉淀,说明含有硫酸根离子,加入AgNO3溶液生成白色沉淀说明含有氯离子,故C正确;
D、NH4Cl固体和Ca(OH)2固体的混合物加热,两者反应了生成NH3,而不是分离,故D错误;
故选C.
点评:本题考查物质性质的分析判断,离子检验方法,注意硝酸根离子在酸性溶液中具有强氧化性,题目难度中等.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.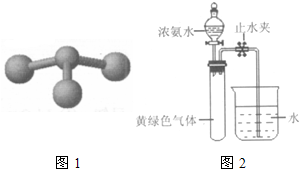 (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁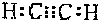
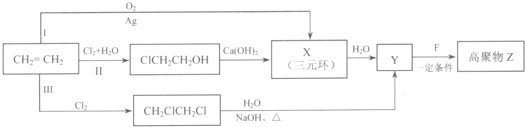
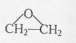
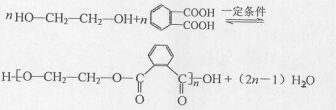
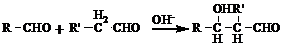 (R、R'代表烃基或氢原子)
(R、R'代表烃基或氢原子)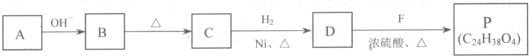
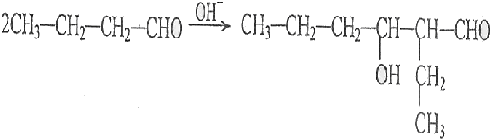
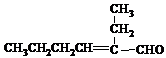
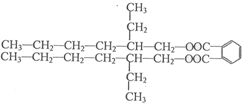
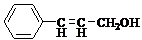 )的合成路线:
)的合成路线: