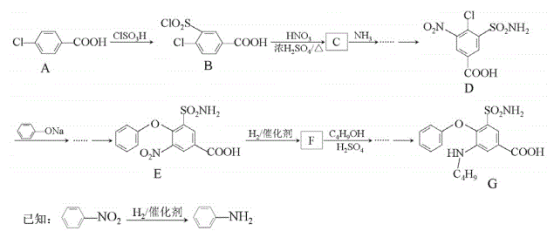
题目内容
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
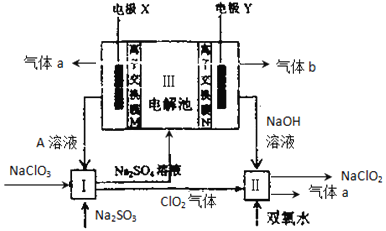
(1)Ⅰ中发生反应的还原剂是___________,气体a的名称是___________
(2)Ⅱ中反应的离子方程式是___________
(3)A的化学式是___________
(4)Ⅲ中电极X是___________,(填“阴极”“阳极”),其上发生 的电极反应为 _______________________。离子交换膜N是 ____(填“阴”“阳”)离子交换膜。
(5)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比是 _______ 。
(6)NaClO2变质可转化为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_____(填“相同”“不相同”“无法判断”)。
【答案】Na2SO3 氧气 2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O; H2SO4 阳极 2H2O4e =O2↑+4H+ (或4OH--4e-=O2+2H2O 阳 1:4 相同
【解析】
ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;硫酸钠溶液通入离子隔膜电解池中,在III中发生电解,根据图知,电极Y生成氢氧化钠,说明电极Y为阴极,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;电极X为阳极,阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,在I中NaClO3、Na2SO3发生氧化还原反应生成ClO2气体和硫酸钠溶液,反应的离子方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,据此分析解答。
(1)根据上述分析,I中NaClO3、Na2SO3发生氧化还原反应生成ClO2气体和硫酸钠溶液,反应的离子方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,失电子化合价升高的反应物是还原剂,还原剂是Na2SO3;气体a是O2,故答案为:Na2SO3;氧气;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水,Ⅱ中反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)通过以上分析知,电解硫酸钠溶液,阳极上氢氧根离子放电生成氧气,同时生成硫酸,所以A是硫酸,硫酸在阳极附近生成,故答案为:H2SO4;
(4)根据上述分析,Ⅲ中电极X阳极,阳极上氢氧根离子放电生成氧气,电极反应式为2H2O4e =O2↑+4H+(或4OH--4e-=O2+2H2O),电极Y为阴极,阴极上生成氢气同时阴极附近生成NaOH,溶液中的钠离子通过离子交换膜N进入阴极区,因此离子交换膜N为阳离子交换膜,故答案为:阳极;2H2O4e =O2↑+4H+ (或4OH--4e-=O2+2H2O);阳;
(5)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以NaClO2作氧化剂;所以该反应中氧化剂和还原剂的物质的量之比为1∶4,故答案为:1∶4;
(6)NaClO2变质可转化为NaClO3和NaCl,Cl元素从+3价变为+5价和-1价,反应为3NaClO2=2NaClO3+NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,最终得到Cl元素由+3价变为-1价,所以NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同,故答案为:相同。

【题目】X、Y是同周期的两种主族元素,他们的逐级电离能(I)数据如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 | …… |
X | 496 | 4562 | 6912 | 9543 | 13353 | …… |
Y | 738 | 1451 | 7733 | 10540 | 13630 | …… |
下到有关说法正确的是( )
A.电负性:X<YB.与水反应剧烈程度:X<Y
C.X的最外层电子数为1D.Y的最高化合价为+3