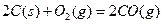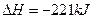题目内容
已知反应:
①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H +(aq)+OH-(aq) ====H2O(l) ΔH=-57.3 kJ·mol-1
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)====P4O10(s) ΔH=-3 093.2 kJ·mol-1
4P(s)+5O2(g)====P4O10(s) ΔH=-2 954.0 kJ·mol-1
下列结论正确的是
①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H +(aq)+OH-(aq) ====H2O(l) ΔH=-57.3 kJ·mol-1
③红磷的化学式为P,白磷的化学式为P4,已知
P4(s)+5O2(g)====P4O10(s) ΔH=-3 093.2 kJ·mol-1
4P(s)+5O2(g)====P4O10(s) ΔH=-2 954.0 kJ·mol-1
下列结论正确的是
| A.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低 |
| B.碳的燃烧热大于221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的反应热ΔH=-57.3 kJ·mol-1 |
| D.浓硫酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ |
D
由题给信息③知,等质量的白磷比红磷燃烧放出的热量多,则等质量的红磷能量比白磷低,红磷转化为白磷是吸热反应,A项错误;燃烧热是指,在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,根据题给信息只能判断碳的燃烧热不是221 kJ·mol-1,B项不正确;稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1,C项错误;由于浓硫酸稀释时放出热量,故浓硫酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ。答案为D项。

练习册系列答案
相关题目
 电子数相同的微粒的化学式 、
电子数相同的微粒的化学式 、 C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定
C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定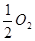 (g)====H2O(l) ΔH=+285.8 kJ·mol-1
(g)====H2O(l) ΔH=+285.8 kJ·mol-1 HBr+HIO 氧化还原反应
HBr+HIO 氧化还原反应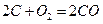 的能量变化如右图所示。下列说法正确的是
的能量变化如右图所示。下列说法正确的是
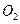 (g)反应生成14 g CO(g),放出的热量为110.5 kJ
(g)反应生成14 g CO(g),放出的热量为110.5 kJ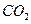 (g),放出的热量大于221 kJ
(g),放出的热量大于221 kJ