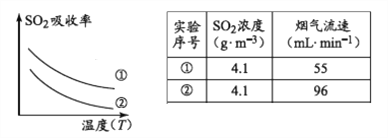
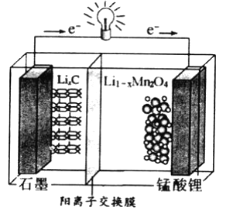
题目内容
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。下列有关说法正确的是
Cr2O72-(橙色)+H2O。下列有关说法正确的是
A.第①步当2v(Cr2O72)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于 CrO42-的生成
C.第②步中,还原 0.1molCr2O72-需要45.6gFeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
【答案】D
【解析】
试题分析:A.没有说明v(Cr2O72-)和v(CrO42-)表示的方向,所以无法判断是否平衡,故A错误;B.加酸后,平衡右移,颜色将会变成橙色,有利于Cr2O72-的生成,故B错误;C.根据电子守恒,还原0.1 mol Cr2O72-需要0.6 mol FeSO4,所以需要91.2 g FeSO4,故C错误;D.第③步沉淀剂a可以使用NaOH等碱性物质,故D正确。故选D。

练习册系列答案
相关题目