题目内容
下面是关于中和滴定的实验叙述:取25.00 mL未知浓度的HCl溶液。在横线标明操作中,有错误的是
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
| A.d、e、f | B.b、d、e、f | C.b、d、e | D.b、c、e、f |
B
试题分析:a.符合酸碱中和滴定的操作要求。正确。b.锥形瓶不能用待测溶液润洗,否则会使滴定结果偏高。错误。C.用酚酞作指示剂以帮助判断滴定终点。正确。D. 用酸式滴定管盛标准酸溶液。正确。e.应该用碱式滴定管盛装标准溶液,再进行滴定。错误。f.若一旦发现溶液由无色变成粉红色,即停止滴定,则可能会因为局部过量,但是整体来说没有摇匀,滴加的标准酸溶液过少,导致待测溶液浓度偏低。错误。因此有错误的叙述是b、d、e、f。选项为B。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目

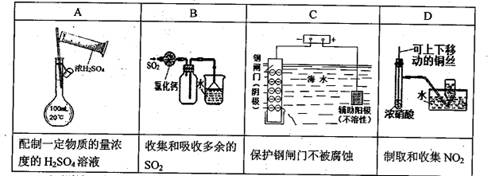
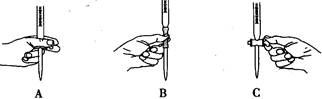
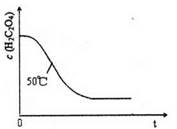
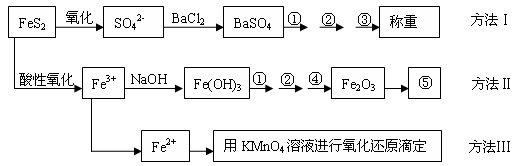
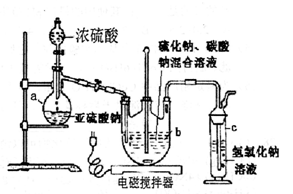
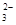 =2I-+S4O
=2I-+S4O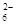 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表: