题目内容
(2012?梧州模拟)[化学-选修有机化学]
某同学探究某有机物A的结构,进行如下实验:
①、取6.2克A在氧气中完全燃烧,将生成气体依次通过M(装有浓硫酸)和N(装有碱石灰)洗气瓶,M增重5.4克,N增重8.8克.
②、测定相对分子质量为62.
③、测定核磁共振氢谱,有两个强峰,比值为2:1
据此回答下列问题:
(1)②中测定相对分子质量的方法为
(2)12.4克A与足量钠反应生成气体的体积为
(3)A与乙酸反应的化学方程式
某同学探究某有机物A的结构,进行如下实验:
①、取6.2克A在氧气中完全燃烧,将生成气体依次通过M(装有浓硫酸)和N(装有碱石灰)洗气瓶,M增重5.4克,N增重8.8克.
②、测定相对分子质量为62.
③、测定核磁共振氢谱,有两个强峰,比值为2:1
据此回答下列问题:
(1)②中测定相对分子质量的方法为
使用质谱法测定相对分子质量
使用质谱法测定相对分子质量
.(2)12.4克A与足量钠反应生成气体的体积为
4.48
4.48
升(标准状况)(3)A与乙酸反应的化学方程式
2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOC CH3+2H2O
| 浓硫酸 |
| △ |
2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOC CH3+2H2O
.| 浓硫酸 |
| △ |
分析:浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,6.2g的该有机物的物质的量=
,水的物质的量=
,二氧化碳的物质的量=
,所以有机物、二氧化碳和水的物质的量之比=0.1mol:0.2mol:0.3mol=1:2:3,所以该有机物分子中含有2个碳原子、6个氢原子,该有机物的相对分子质量是46,所以该分子中还含有2个氧原子,其化学式为C2H6O2,核磁共振氢谱中,氢原子种类和吸收峰个数相等,据此确定该有机物的结构简式.
| 6.2g |
| 62g/mol |
| 5.4g |
| 18g/mol |
| 8.8g |
| 44g/mol |
解答:解:(1)测定相对分子质量的常用的仪器是质谱,所以测定相对分子质量的方法为使用质谱法测定相对分子质量,
故答案为:使用质谱法测定相对分子质量;
(2)浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,6.2g的该有机物的物质的量=
,水的物质的量=
,二氧化碳的物质的量=
,所以有机物、二氧化碳和水的物质的量之比=0.1mol:0.2mol:0.3mol=1:2:3,所以该有机物分子中含有2个碳原子、6个氢原子,该有机物的相对分子质量是46,所以该分子中还含有2个氧原子,其化学式为C2H6O2,测定核磁共振氢谱,有两个强峰,比值为2:1,则其结构简式为HOCH2CH2OH;
12.4克A的物质的量为
=0.2mol,HOCH2CH2OH~2Na~H2,所以生成氢气为0.2mol,则V=n?Vm=0.2mol×22.4L/mol=4.48L;
故答案为:4.48;
(3)A的结构简式为HOCH2CH2OH,属于二元醇能与乙酸发生酯化反应,其反应方程式为:2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOC CH3+2H2O,
故答案为:2CH3COOH+HOCH2CH2OH
CH3COOCH2CH2OOCCH3+2H2O.
故答案为:使用质谱法测定相对分子质量;
(2)浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,6.2g的该有机物的物质的量=
| 6.2g |
| 62g/mol |
| 5.4g |
| 18g/mol |
| 8.8g |
| 44g/mol |
12.4克A的物质的量为
| 12.4g |
| 62g/L |
故答案为:4.48;
(3)A的结构简式为HOCH2CH2OH,属于二元醇能与乙酸发生酯化反应,其反应方程式为:2CH3COOH+HOCH2CH2OH
| 浓硫酸 |
| △ |
故答案为:2CH3COOH+HOCH2CH2OH
| 浓硫酸 |
| △ |
点评:本题考查了有机物分子式的确定,明确浓硫酸和碱石灰吸收的物质及各物质物质的量之间的关系是解本题关键,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
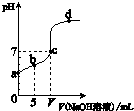 (2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( )
(2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( )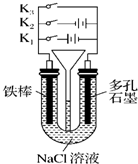 (2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )
(2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )