题目内容
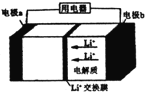
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为![]() ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
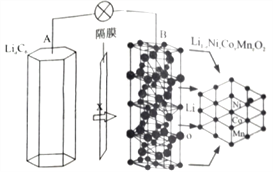
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
【答案】D
【解析】A. 根据LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6可知,X为Li+。允许离子 Li+通过的隔膜属于阳离子交换膜,故A错误;B. 根据充电时电池总反应LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,A上发生C(石墨)→LiaC6的反应,是还原反应,A为阴极,Li+没有发生氧化还原反应,故B错误;C. 根据充电时电池总反应,无法充电的废旧电池的石墨电极中没有锂元素,不能回收金属锂,故C错误;D. 放电时,总反应为Li1-aNixCoyMnzO2+LiaC6= LiNixCoyMnzO2+6C(石墨),正极发生还原反应,电极反应式为Li1-aNixCoyMnzO2+aLi++ae-= LiNixCoyMnzO2,故D正确;故选D。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1