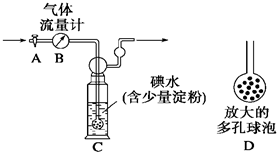
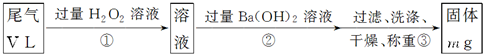题目内容
(2013?长沙模拟)2SO2(g)+O2(g)
| ||||||||||||||||||||||
分析:A.温度相同时,该反应的平衡常数不变;
B.根据甲中各物质的平衡浓度计算平衡常数;
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化.
B.根据甲中各物质的平衡浓度计算平衡常数;
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化.
解答:解:A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B.根据2SO2(g)+O2(g)
2SO3(g),
开始 0.4 0.24 0
转化 0.32 0.16 0.32
平衡 0.08 0.08 0.32
平衡浓度0.04 0.04 0.16
所以该温度下,平衡常数值为
=400,故B正确;
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,故C错误;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,则乙中O2的转化率大于甲中O2的转化率,故D错误;
故选B.
B.根据2SO2(g)+O2(g)
| 催化剂 |
| 加热 |
开始 0.4 0.24 0
转化 0.32 0.16 0.32
平衡 0.08 0.08 0.32
平衡浓度0.04 0.04 0.16
所以该温度下,平衡常数值为
| (0.16mol/L)2 |
| (0.04ol/L)2×0.04mol/L |
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,故C错误;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,则乙中O2的转化率大于甲中O2的转化率,故D错误;
故选B.
点评:本题考查化学平衡的计算,熟悉化学平衡的三段法计算及影响平衡移动的因素即可解答,注意平衡常数只与温度有关,计算平衡常数应利用平衡浓度,题目难度中等.

练习册系列答案
相关题目