题目内容
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图3-5所示,请完成下列问题: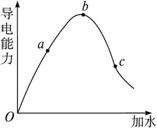
图3-5
(1)“O”点导电能力为0的理由__________________________________________________。
(2)a、b、c三点溶液的pH由小到大的顺序为_____________。
(3)a、b、c三点中电离度最大的是______________。
(4)若使c点溶液的[CH3COO-]增大,溶液的pH也增大,可采取的措施为①____________;②____________;③____________。
解析:本题考查冰醋酸加水稀释过程之中的电离程度与导电能力之间的关系,因为冰醋酸是共价型的分子,熔融条件下不电离,没有自由移动的离子,所以“O”点时的导电能力为0;导电能力的强弱与溶液中的氢离子等离子的浓度直接相关,而氢离子的浓度则与pH密切相关,据此不难得出c点时的氢离子浓度最小,pH最高;纯弱电解质在加水稀释的过程中,电离程度是一直变大的,所以电离程度最大的是c点;若使c点溶液的[CH3COO-]增大,溶液的pH也增大,须通过消耗氢离子,使平衡正向移动才行。
答案:(1)由于醋酸为共价化合物,在固、液态时不存在离子,也就谈不上存在自由移动的离子,所以不导电
(2)b<a<c
(3)c
(4)加NaOH(s) 加Mg 加Na2CO3(s)

 ABC考王全优卷系列答案
ABC考王全优卷系列答案(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 |
| 不填 | 不填 |
| 加水 |
|
| 不填 |
| 加盐酸 | 不填 |
|
|
| 加少量氢氧化钠固体 | 不填 | 不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____10C(H+)乙(填“大于”、“小于”或 “等于”),
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )