题目内容
(2008?南京一模)(1)前三周期元素中第一电离能最小的是
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是
(3)晶格能的大小:MgO
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.Cl4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
Na
Na
(填元素符号),其基态原子的电子排布式为1S22S22P63S1
1S22S22P63S1
.第二周期非金属元素形成的氢化物中化学键极性最大的是HF
HF
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度小
小
(填“大”或“小”).(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是
B
B
(填物质字母代号).(3)晶格能的大小:MgO
>
>
NaCl,键能的大小:HBr>
>
HI.(填“>”、“=”或“<”)(4)下列物质的熔点高低顺序,正确的是
B
B
| 代号 | 物质 | 结构式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 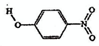 |
1.7 | 114 | 295 |
B.Cl4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
分析:(1)前三周期元素中Na最容易失去第一电子,故Na的第一电离能最小;1S22S22P63S1;氢化物中两种元素非金属性差别越大,化学键极性越大;HF为极性分子且在水中能与水形成氢键,所以在水中溶解度大于在CCl4中的溶解度;
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大;非金属性越强,半径越小,共价键键能越大.
(4)A.原子晶体半径越小,熔点越高;
B.结构相似的分子晶体分子量越大熔点越高;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体.
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大;非金属性越强,半径越小,共价键键能越大.
(4)A.原子晶体半径越小,熔点越高;
B.结构相似的分子晶体分子量越大熔点越高;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答:解:(1)前三周期元素中Na最容易失去第一电子,故Na的第一电离能最小,由电子排布式的书写规律可以写出Na的排布式为1S22S22P63S1,氢化物中两种元素非金属性差别越大,化学键极性越大,HF为极性分子且在水中能与水形成氢键,所以在水中溶解度大于在CCl4中的溶解度,
故答案为:Na;1S22S22P63S1;HF;小;
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键,故选B;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大,则晶格能的大小:MgO>NaCl,非金属性越强,半径越小,共价键键能越大,则键能的大小:HBr
>HI,
故答案为:>;>;
(4)A.原子半径N<C<Si,原子晶体半径越小,键能越大,则熔点越高,故A错误;
B.结构相似的分子晶体分子量越大,分子间作用力越强,则熔点越高,故B正确;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体,故D错误;
故答案为:B.
故答案为:Na;1S22S22P63S1;HF;小;
(2)形成分子间氢键能增大其熔沸点,对-硝基苯酚熔沸点高,说明形成的是分子间氢键,故选B;
(3)离子化合物中离子半径越小,所带电荷越多,晶格能越大,则晶格能的大小:MgO>NaCl,非金属性越强,半径越小,共价键键能越大,则键能的大小:HBr
>HI,
故答案为:>;>;
(4)A.原子半径N<C<Si,原子晶体半径越小,键能越大,则熔点越高,故A错误;
B.结构相似的分子晶体分子量越大,分子间作用力越强,则熔点越高,故B正确;
C.熔点的一般规律:原子晶体>离子晶体>分子晶体,故D错误;
故答案为:B.
点评:本题考查了分子晶体、离子晶体、原子晶体的熔沸点的比较,以及相似相溶原理,氢键等知识.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
