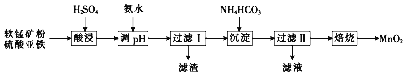
题目内容
【题目】已知草酸H2C2O4是二元弱酸。室温下向10 mL 0.01 mol·L-1 H2C2O4溶液中逐滴加入0.01 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
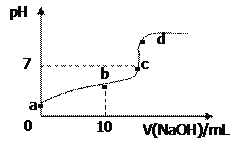
A. a点pH>2
B. b点表示的溶液中c(C2O42-)>c(H2C2O4)
C. c点时加入NaOH溶液的体积为20mL
D. d点存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)
【答案】C
【解析】A、草酸是弱酸,a点 0.01molL-1 H2C2O4溶液的pH>2,故A正确;B、b点加入10mL氢氧化钠,得到的是草酸氢钠溶液,显示酸性,该溶液中,草酸氢根离子的电离程度大于水解,所以c(C2O42-)>c(H2C2O4),故B正确;C、加入NaOH溶液的体积为20mL时,得到的是草酸钠溶液,溶液显示碱性,不是中性,故C错误;D、d点得到的溶液是草酸钠和氢氧化钠的混合物,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-),故D正确;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
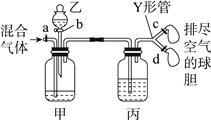
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D