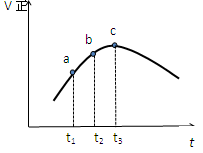
题目内容
一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g) CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:

 CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
CO2(g)十H2 (g) △H<0。在850℃时,CO和H2O浓度变化如下左图;若在t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。下列说法正确的是:
| A.850℃时,按左图所示0~4min用CO2表示的平均反应速率v(CO2)=0.02mol·L-1·min-1 |
| B.t1℃高于850℃ |
| C.t1℃时,反应在4min~5min间,平衡向逆反应方向移动,若其它条件不变,可能的原因是增大压强 |
| D.若t2℃时,各物质的平衡浓度符合c(CO2)·c(H2)=2 [c(CO)·c(H2O)],则t2℃高于850℃ |
B
试题分析:A、因图中没有CO2的浓度变化曲线,所以只有通过CO 和H2O浓度,通过三段式间接计算CO2的变化浓度,即 CO(g)十H2O(g)
 CO2(g)十H2 (g)
CO2(g)十H2 (g) 起始浓度(mol/L) 0.2 0.3 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
4分钟时浓度不变,达到平衡,则v(CO2)=0.12mol/L÷4min=0.03 mol·L-1·min-1,A不正确;
B、观察右表数据,第3分钟时达到平衡,说明达到平衡的时间缩短,速率更快,则温度应该更高,所以B正确;
C、根据方程式计量数可知,该反应是体积不变的,即使增大压强,平衡也不移动,而表中数据说明4~5分钟时,CO和H2O的浓度再增大,CO2的浓度再减小,平衡应该是逆向移动,可能的原因是升高温度,C不正确;
D、根据方程式可知,该反应的平衡常数表达式K=
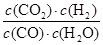 ,850℃时K=
,850℃时K=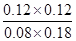 =1。此时(CO2)·c(H2)=2 [c(CO)·c(H2O)],即K=2>1。这说明平衡正向移动,则温度降低,应低于850℃,D不正确,答案选B。
=1。此时(CO2)·c(H2)=2 [c(CO)·c(H2O)],即K=2>1。这说明平衡正向移动,则温度降低,应低于850℃,D不正确,答案选B。
练习册系列答案
相关题目


 ,下列有关说法正确的是( )
,下列有关说法正确的是( ) 2SO3(g),根据下表中的数据判断下列图像错误的是
2SO3(g),根据下表中的数据判断下列图像错误的是

 Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
 PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
 CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
 H2(g) +CO2(g)平衡常数K随温度的变化如下表:
H2(g) +CO2(g)平衡常数K随温度的变化如下表:
 2C0 Cg)平衡常数K1;
2C0 Cg)平衡常数K1; CO Cg) +H2(g)平衡常数K2
CO Cg) +H2(g)平衡常数K2

 Z(g)达到平衡,正反应速率随时间的变化如图所示,下列叙述不正确的是( )
Z(g)达到平衡,正反应速率随时间的变化如图所示,下列叙述不正确的是( )