题目内容
【题目】将24.4gNaOH固体溶于水,配成100mL溶液,其密度为1.22g/mL,请回答下列问题。
(1)从该溶液中取出10mL,其中NaOH的物质的量浓度为________,NaOH的质量分数为___________,溶液的密度为________,含NaOH的物质的量为_________;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为_______。
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,可使相同体积的Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42ˉ完全沉淀,则三种硫酸盐的物质的量浓度之比为____。
【答案】6.1mol/L 20% 1.22g/mL 0.061mol 0.61mol/L 6:3:2
【解析】
(1)根据物质的量与质量或与物质的量浓度的计算公式计算,根据溶液稀释公式分析。
(2)根据反应过程中离子之间的比例关系分析。
(1)24.4gNaOH的物质的量为24.4g÷40g/mol=0.6mol,其物质的量浓度为0.61mol÷0.1L=6.1mol/L;溶液的质量为1.22g/mL×100mL=122g,质量分数为![]() =20%;溶液的密度为1.22g/mL;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为原来的十分之一,即为0.61mol/L,其中氢氧化钠的物质的量是0.061mol;
=20%;溶液的密度为1.22g/mL;将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为原来的十分之一,即为0.61mol/L,其中氢氧化钠的物质的量是0.061mol;
(2)用等体积的0.2mol·Lˉ1的BaCl2溶液,反应的硫酸根离子物质的量相同,所以Na2SO4、KAl(SO4)2、Fe2(SO4)3三种物质的物质的量比为:1:1/2:1/3=6:3:2。

【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
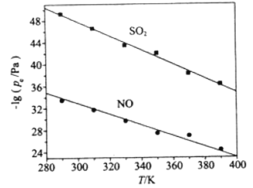
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32 2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。



