题目内容
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问.久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究.提出假设:根据久置KI固体会被氧化而变质,结合空气的成分,首先排除
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三:
实验验证:(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸.一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
| 试管序号 | 1 | 2 | 3 | 4 | 5 |
| 通入CO2时间/min | 0 | 1 | 5 | ||
| 滴加盐酸/滴 | 0 | 3 | 6 | ||
| 溶液中颜色对比 | 无色 | 浅黄色→黄色(依次加深) | |||
| 滴加淀粉溶液后的颜色对比 | 无色 | 浅蓝色→蓝色(依次加深) | |||
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
| 实验步骤 | 预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; | / |
| ②一份加入到装有 一份加入到装有 ③几天后观察. |
实验验证:(1)由表中数据可知,滴加盐酸或通入二氧化碳都可使颜色变深,说明二氧化碳与盐酸一样可提供酸性环境,在酸性条件下KI可被氧气氧化;
(2)验证I-被氧化是否必须要有H2O的参与,可进行对比实验:一份为干燥的二氧化碳和氧气,另一份为湿润的二氧化碳和氧气,根据集气瓶固体是否变色进行判断.
实验验证:(1)由表中数据可知,滴加盐酸或通入二氧化碳都可使颜色变深,说明二氧化碳与盐酸一样可提供酸性环境,在酸性条件下KI可被氧气氧化,CO2与KI反应的化学方程式为4KI+O2+2CO2=2K2CO3+2I2,故答案为:酸性;4KI+O2+2CO2=2K2CO3+2I2;
(2)验证I-被氧化是否必须要有H2O的参与,可进行对比实验:一份为干燥的二氧化碳和氧气,另一份为湿润的二氧化碳和氧气,根据集气瓶固体是否变色进行判断,
若集气瓶A中的KI固体颜色变黄,则氧化KI可以不需要H2O参加;若集气瓶A中的KI固体颜色不变,而集气瓶B的KI固体颜色变黄,则氧化KI必须要有H2O参加,
故答案为:
| 实验步骤 | 预期现象和结论 |
| / | |
| 干燥的二氧化碳和氧气;湿润的二氧化碳和氧气 | 若集气瓶A中的KI固体颜色变黄,则氧化KI可以不需要H2O参加;若集气瓶A中的KI固体颜色不变,而集气瓶B的KI固体颜色变黄,则氧化KI必须要有H2O参加 |

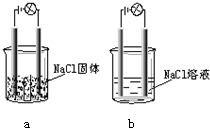 某校化学兴趣小组同学在实验室做实验,按照如图a图连接好线路发现小灯泡不亮,按照如图b图连接好线路发现小灯泡会亮,由此得出的结论正确的是( )
某校化学兴趣小组同学在实验室做实验,按照如图a图连接好线路发现小灯泡不亮,按照如图b图连接好线路发现小灯泡会亮,由此得出的结论正确的是( )| A、NaCl固体是非电解质 | B、NaCl在水中能电离出可以自由移动的离子 | C、NaCl能使溶液中的水电离出大量的离子 | D、NaCl溶液是电解质 |
某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。
【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除 和稀有气体的影响。然后对KI变质条件提出合理假设:
假设一:需要H2O的参与;
假设二:需要CO2的参与;
假设三: 。
【实验验证】
(1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表:
|
试管序号 |
1 |
2 |
3 |
4 |
5 |
|
通入CO2时间/min |
0 |
1 |
5 |
|
|
|
滴加盐酸/滴 |
0 |
|
|
3 |
6 |
|
溶液中颜色对比 |
无色 |
浅黄色→黄色(依次加深) |
|||
|
滴加淀粉溶液后的颜色对比 |
无色 |
浅蓝色→蓝色(依次加深) |
小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供 环境。
写出此实验中CO2与KI反应的化学方程式 。
(2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证:
|
实验步骤 |
预期现象和结论 |
|
①取一份纯净的KI固体,分成两等份; |
|
|
②一份加入到装有 的集气瓶A中; 一份加入到装有 的集气瓶A中; ③几天后观察。 |
|
【交流提高】
由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、 。
 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.