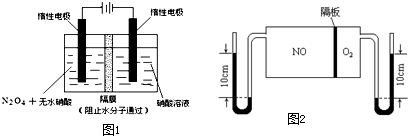
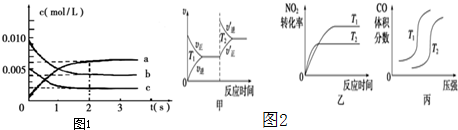
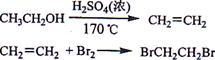
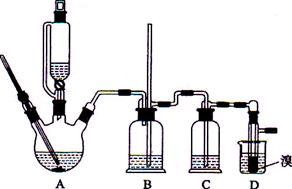
题目内容
在密闭容器中,将2.0molCO与10molH2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g)K=1.0
①该反应的平衡常数表达式是:______
②CO转化为CO2的转化率为:______.
| 催化剂 |
①该反应的平衡常数表达式是:______
②CO转化为CO2的转化率为:______.
①、可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数表达式k=
,
故答案为:
;
②、令平衡时参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)
CO2(g)+H2(g)
开始(mol):210 0 0
变化(mol):n n n n
平衡(mol):2-n 10-n n n
故
=1
解得:n=
故CO的转化率为
×100%=83.3%,
故答案为:83.3%.
| 催化剂 |
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
故答案为:
| c(CO2)?c(CO2) |
| c(CO2)?c(CO2) |
②、令平衡时参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)
| 催化剂 |
开始(mol):210 0 0
变化(mol):n n n n
平衡(mol):2-n 10-n n n
故
| n×n |
| (2-n)×(10-n) |
解得:n=
| 5 |
| 3 |
故CO的转化率为
| ||
| 2mol |
故答案为:83.3%.

练习册系列答案
相关题目
 2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )