题目内容
(1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH= ;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH= 。
(1) 1 13 (2) 8
解析试题分析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为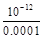 mol/L =10-8mol/L,pH=8。
mol/L =10-8mol/L,pH=8。
考点:pH计算
点评:计算碱溶液pH时利用c(H+)=  ,再求pH。
,再求pH。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
(4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。
|
物质(微粒)及编号 |
电离度α |
|
A.硫酸溶液(第一步完全电离): HSO |
10% |
|
B.硫酸氢钠溶液:HSO |
29% |
|
CH3COOH |
1.33% |
|
D.盐酸:HCl=H++Cl- |
100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是_____(填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO的电离度,其原因是__________________。
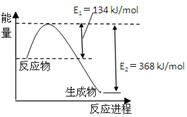
 N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。 H++SO
H++SO H++SO
H++SO COOH
COOH CH3COO-+H+
CH3COO-+H+