题目内容
用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A.84gNaHCO3晶体中含有NA个CO32- |
| B.9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
| C.标准状况下,11.2L臭氧中含NA个氧原子 |
| D.78gNa2O2与足量的CO2反应,电子转移个数为2NA |
B
解析试题分析:A、NaHCO3晶体中不存在CO32-,错误;B、NO2和N2O4的最简式相同都为NO2,所以9.2g的混合气体中含NO2为0.2mol,氮原子数为0.2NA,正确;C、标准状况下,11.2L臭氧的物质的量为0.5mol,所以氧原子数为1.5NA,错误;D、Na2O2与足量的CO2反应中,Na2O2既作氧化剂又作还原剂,所以78gNa2O2与足量的CO2反应,电子转移个数为NA,错误,答案选B。
考点:考查阿伏伽德罗常数的理解应用

 中考解读考点精练系列答案
中考解读考点精练系列答案NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2 L H2O中氧原子的数目大于0.5 NA |
| B.6.0 g醋酸晶体中含有H+的数目为0.1 NA |
| C.64gCu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA |
| D.1 mol Cl-含有的核外电子总数为8 NA |
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是
| A.称取7.68 g硫酸铜,加入500 mL水 |
| B.称取12.0 g胆矾配制500 mL溶液 |
| C.称取8.0 g硫酸铜,加入500 mL水 |
| D.称取12.5 g 胆矾配制500 mL溶液 |
某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示:下列说法不正确的是
| 盐酸/mL | 50 | 50 | 50 |
| 固体混合物质量/g | 9.2 | 15.7 | 27.6 |
| 标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入9.2 g固体混合物时盐酸过量
D.15.7 g固体混合物恰好与盐酸完全反应
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
| A.1 mol·L-1 NaCl溶液含有NA个Na+ |
B.1 mol Cu和足量稀硝酸反应产生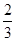 NA个NO分子 NA个NO分子 |
| C.1 L 0.1 mol·L-1氨水含有0.1NA个OH- |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
| A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA |
| B.常温下,0.1 mol·L-1 NH4NO3溶液中NO3-数目为0.1NA |
| C.常温常压下,4.0 g CH4中含有共价键的数目为NA |
| D.标准状况下,22.4 L CHCl3含有分子的数目为NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。
| A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
| B.常温常压下,16 g 14CH4所含中子数目为8NA |
| C.常温常压下,7.1 g Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA |
| D.标准状况下,22.4 L空气含有NA个单质分子 |
设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有( )。
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③将含0.1 mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
| A.①②③ | B.①②④ | C.①②③④ | D.②④ |
有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为31.5%,氯元素的质量分数为27.08%,则Na2CO3的质量分数为( )
| A.38% | B.50% | C.75% | D.80% |