题目内容
在溶液中进行某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol?L-1)随反应时间(min)的变化情况如下表:

(1)在实验1,反应在10min~20min时间内平均速率(VA)为 mol/(L?min)。
(2)在实验2,A的初始浓度C2= mol?L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填“>”、“=”、“<”),且C3 1.0 mol/L(填“>”、“=”、“<”)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
(1)0.013
(2)1.0;加入催化剂
(3)>;>
(4)吸热;温度高A的浓度降低,说明升温平衡向正向移动,则正向是吸热反应。

(10 分)
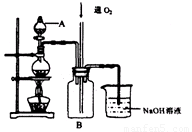
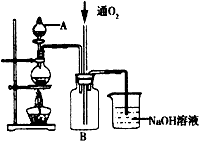
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节 ,产生
,产生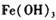 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使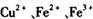 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
|
物质 |
开始沉淀时的PH |
完全沉淀时的PH |
|
Fe(OH)3 |
1.9 |
3. 2 |
|
Cu(OH)2 |
4. 7 |
6. 7 |
|
Fe(OH)2 |
6. 3 |
9. 7 |
请回答下列问题:
①物质甲 是_____ (填字母序号)。
a.
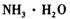 b.
b.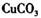 c.
c.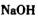 d.
d.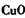
②该方案中调节PH的范围是______ 。

(10 分)
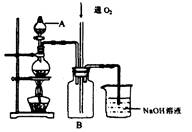
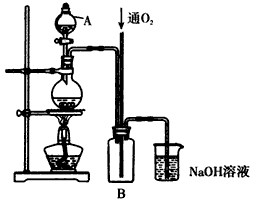
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把![]() 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节![]() ,产生
,产生![]() 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使![]() 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
| 物质 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe(OH)3 | 1.9 | 3. 2 |
| Cu(OH)2 | 4. 7 | 6. 7 |
| Fe(OH)2 | 6. 3 | 9. 7 |
请回答下列问题:
①物质甲 是 (填字母序号)。
a. ![]() b.
b.![]() c.
c.![]() d.
d.![]()
②该方案中调节PH的范围是 。