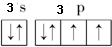
题目内容
 按要求填写下列空白.
按要求填写下列空白.(1)高岭石一种硅酸盐矿物,其化学式为Al4Si4O10(OH)8,用氧化物的形式表示为
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂.
①Fe2O3(Al2O3)
③SO2 (HCl)
(3)为鉴定硅产品中是否含有微量铁单质,将硅产品用稀盐酸溶解,取上层清液后需要加入的试剂是
a.氯水 b.NaOH溶液 c.KSCN溶液 d.Na2SO3溶液
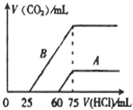
(4)取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2 后,再分别稀释为100mL.在稀释后的溶液中分别逐滴加入0.1mol?L-1 的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:
①A曲线表明,原NaOH溶液通入CO2后,所得溶液中的溶质的化学式为
②B曲线表明,原NaOH溶液通入CO2后,所得溶液中的溶质的化学式为
③原NaOH溶液的物质的量浓度是
分析:(1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物?较活泼金属氧化物?SiO2?H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)①Al2O3是两性氧化物,具有两性氧化物的通性,溶于强酸强碱;②根据一氧化氮、二氧化氮的性质分析;③氯化氢能与饱和NaHSO3溶液反应,二氧化硫和亚硫酸氢钠溶液不反应;④铁粉能与FeCl3反应生成FeCl2,铁粉不能与FeCl2反应;
(3)取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe;
(4)①当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
②逐滴加入0.1mol?L-1 的盐酸,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
③先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
(2)①Al2O3是两性氧化物,具有两性氧化物的通性,溶于强酸强碱;②根据一氧化氮、二氧化氮的性质分析;③氯化氢能与饱和NaHSO3溶液反应,二氧化硫和亚硫酸氢钠溶液不反应;④铁粉能与FeCl3反应生成FeCl2,铁粉不能与FeCl2反应;
(3)取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe;
(4)①当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
②逐滴加入0.1mol?L-1 的盐酸,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
③先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
解答:解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物?较活泼金属氧化物?SiO2?H2O得顺序可知Al4Si4O10(OH)8可改成:2Al2O3?4SiO2?4H2O,
故答案为:2Al2O3?4SiO2?4H2O;
(2)①Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应化学方程式:Al2O3+2NaOH═2NaAlO2+H2O,则可用氢氧化钠溶液除去Al2O3杂质,
故答案为:NaOH溶液;
②二氧化氮和水反应生成硝酸和一氧化氮H2O+3NO2=2HNO3+NO,一氧化氮和水不反应,所以可用水除去一氧化氮中的二氧化氮,
故答案为:H2O;
③氯化氢能与饱和NaHSO3溶液反应生成二氧化硫、水和氯化钠,二氧化硫和亚硫酸氢钠溶液不反应,可用饱和NaHSO3溶液除去二氧化硫中的氯化氢气体,反应的离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:饱和亚硫酸氢钠溶液;
④因铁粉能与FeCl3反应生成FeCl2,铁粉不能与FeCl2反应,能除去杂质且没有引入新的杂质,符合除杂原则,反应的离子方程式为2Fe3++Fe═3Fe2+,
故答案为:铁粉;
(3)铁能和酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,
故答案为:ac;
(4)①当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是氢氧化钠和碳酸钠,
故答案为:NaOH 和Na2CO3;
②当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是碳酸钠和碳酸氢钠,
故答案为:Na2CO3和NaHCO3;
③先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为cmol/L,加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=7.5×10-3mol,c(NaOH)=
=
=0.15mol/L,
故答案为:0.15mol/L.
故答案为:2Al2O3?4SiO2?4H2O;
(2)①Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应化学方程式:Al2O3+2NaOH═2NaAlO2+H2O,则可用氢氧化钠溶液除去Al2O3杂质,
故答案为:NaOH溶液;
②二氧化氮和水反应生成硝酸和一氧化氮H2O+3NO2=2HNO3+NO,一氧化氮和水不反应,所以可用水除去一氧化氮中的二氧化氮,
故答案为:H2O;
③氯化氢能与饱和NaHSO3溶液反应生成二氧化硫、水和氯化钠,二氧化硫和亚硫酸氢钠溶液不反应,可用饱和NaHSO3溶液除去二氧化硫中的氯化氢气体,反应的离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:饱和亚硫酸氢钠溶液;
④因铁粉能与FeCl3反应生成FeCl2,铁粉不能与FeCl2反应,能除去杂质且没有引入新的杂质,符合除杂原则,反应的离子方程式为2Fe3++Fe═3Fe2+,
故答案为:铁粉;
(3)铁能和酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,
故答案为:ac;
(4)①当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是氢氧化钠和碳酸钠,
故答案为:NaOH 和Na2CO3;
②当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是碳酸钠和碳酸氢钠,
故答案为:Na2CO3和NaHCO3;
③先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为cmol/L,加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=7.5×10-3mol,c(NaOH)=
| n |
| v |
| 7.5×10-3mol |
| 0.05L |
故答案为:0.15mol/L.
点评:本题比较综合,考查了硅酸盐矿物氧化物的表示形式、除杂问题、混合物的计算等有关知识,注意在解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质),注意混合物的有关计算关键根据图中盐酸的体积计算出NaOH、CO2的物质的量,判断CO2与NaOH反应过程,题目难度较大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目