题目内容
用二氧化氯(ClO2)、铁酸钠(Na2FeO4,摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是____________。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是_________________。
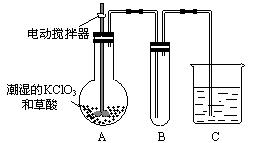
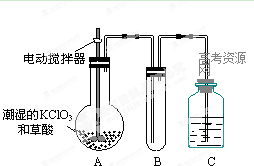
(3)二氧化氯是一种黄绿色的有刺激性气味的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水,ClO2可以看作是亚氯酸和氯酸的混合酸酐,工业上用稍潮湿的KClO3和草酸在60 ℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。

请完成下列问题:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置?_____________
______________________________________________________________。
②C中应盛放的试剂为_____________________。
(1)ClO2>Cl2>Na2FeO4
(2)铁酸钠的还原产物为Fe3+,能水解生成Fe(OH)3胶体,吸附水中悬浮物,从而净化
(3)①(冷水)冷凝装置 ②NaOH溶液
解析:本题为信息题,主要考查氧化还原反应的基本知识:
(1)依据化合价变化情况可知:ClO2![]() Cl-得电子5e-;Na2FeO4
Cl-得电子5e-;Na2FeO4![]() Fe3+,得电子3e-;Cl2
Fe3+,得电子3e-;Cl2![]() 2Cl-,得电子2e-。现假定均得到1 mol电子,则需ClO2的质量为
2Cl-,得电子2e-。现假定均得到1 mol电子,则需ClO2的质量为![]() mol×67.5 g·mol-1=13.5 g,同理可知需Na2FeO4的质量为
mol×67.5 g·mol-1=13.5 g,同理可知需Na2FeO4的质量为![]() mol×166 g·mol-1=55.3 g,Cl2的质量为
mol×166 g·mol-1=55.3 g,Cl2的质量为![]() mol×71 g·mol-1=35.5 g,质量由大到小顺序为ClO2、Cl2、Na2FeO4。
mol×71 g·mol-1=35.5 g,质量由大到小顺序为ClO2、Cl2、Na2FeO4。
(2)由于Fe(OH)3胶体具有吸附性,有净水的功能。
(3)由“ClO2的沸点为11 ℃”这一信息可知,应采用适当冷却的方法使ClO2成为液体,故可考虑使用冷凝装置,由“ClO2可以看作是亚氯酸和氯酸的混合酸酐”这一信息可知,ClO2可与碱反应,故C中放置碱溶液,解答本题时应注意充分捕捉信息、运用信息。

 阶梯计算系列答案
阶梯计算系列答案 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.