题目内容
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
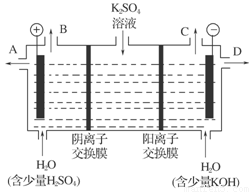
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(1)2NaCl(熔融)2Na+Cl2↑'(2)13
(3)NaCl+H2ONaClO+H2↑
(4)①4OH--4e-===2H2O+O2↑'小于'②D
③H+放电,促进水的电离,OH-浓度增大
④O2+2H2O+4e-===4OH-
【解析】(1)工业上通过电解熔融氯化钠来制备钠。(2)电解氯化钠溶液的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,当阴阳两极均得到112 mL标准状况下的气体时,生成NaOH的物质的量为0.01 mol,此时溶液中c(OH-)==0.1 mol/L,则pH=13。 (3)电解氯化钠溶液制备次氯酸钠可以分为两步,第一步:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;第二步:Cl2+2NaOH===NaCl+NaClO+H2O。将两步合并即得:NaCl+H2ONaClO+H2↑。(4)电解K2SO4溶液时,阳极附近OH-放电生成氧气,阴极附近是H+放电生成氢气,由于装置中放置了离子交换膜在两极分别生成KOH和H2SO4,需在阳极室一侧放置阴离子交换膜,允许通过的是阴离子,即SO42-和OH-,阴极室一侧放置阳离子交换膜,允许通过的是阳离子,即K+,H+,由于SO42-与K+的个数比为1 ∶2,故通过阴离子交换膜的离子比通过阳离子交换膜的少。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案(8分)(2011·泰州模拟)某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。
(8分)(2011·苏北四市调研)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:
C(s)+H2O(g) CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1,
ΔS=+133.7 J·(K·mol)-1
①该反应能否自发进行与________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验 组 | 温度/ ℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(H2)表示的反应速率为_________________________________________。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表: