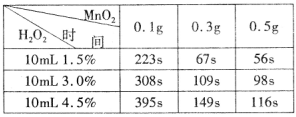
题目内容
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中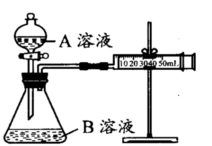
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| ② | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性: 。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸): 。
(3)该实验探究的是 对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器: 。你将如何比较①②组化学反应速率大小?你的操作是 。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4) (10-4mol/(L·min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
(4)完成上表中υ= ×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是 。
②请设计实验证明你的观点,写出实验步骤及结论:
| 实验步骤及结论: |
(共17分)
(1)关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好。(2分)
(2)2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O(2分)
(3)浓度(1分) 秒表(1分)
比较在该环境中,相同时间收集到的气体体积,多的反应速率快(或比较在该环境中,比较收集相同体积气体所用时间,越短速率越快)(2分)
(4)0.11(3分)
①反应过程中产生了催化剂加快了反应速率(如果答生成的Mn2+对反应有催化作用也给分)(2分:
(或其他合理答案也给分)实验步骤及结论:(答案合理即可)
实验步骤:首先,取两支试管分别加入等体积上述酸性KMnO4溶液;接下来,向其中一支试管中加入少许MnSO4固体;最后,同时分别向两支试管中加入等体积的上述H2C2O4溶液,观察两支试管中颜色褪去的时间长短。(2分)
结论:若加有MnSO4固体试管褪色时间短,则证明是生成的Mn2+作催化剂。(2分)
解析试题分析:本题以课本实验为基础,探究影响化学反应速率的因素,首先应该联系课本知识,了解影响化学反应速率的因素有哪些以及氧化还原知识,实验基本操作等基础知识,然后运用恰当的方法进行解题。
(1)考查气密性的检查,在这个相对密封的体系,打开分液漏斗,开始用液体流下,后停止,并保持,说明气密性良好或通过活塞的推动,也可判断;
(2)氧化还原反应方程式的书写
(3)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
(4)根据相关数据可以计算出速率的大小;从数据看出反应的速率先增大后减小,故可以考虑催化剂的影响。
考点:以探究实验为基础,考查影响化学反应速率的因素、化学实验基本操作、氧化还原反应基础知识等。

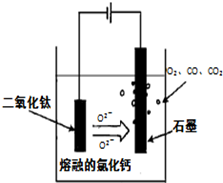
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,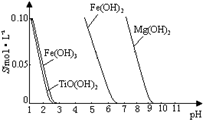
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 | T/K | c(Na2S2O3)/ mol·L-1 | c(H2SO4)/ mol·L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② | 308 | | | |
| ③ | | 0.2 | | |
| ④ | | 0.1 | |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________ (提示:S元素被氧化为SO)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂: 1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 | |
| 步骤2: | |
| 步骤3: | |
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。
(忽略温度对反应速率的影响)
某学习小组设计如下实验方案,相关推测不合理的是
| A.试管②滴入酚酞后溶液可能变浅红 |
| B.试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C.试管④中的变化是物理变化 |
| D.上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
用水稀释0.1mol·L-1 氨水时,溶液中随着水量的增加而减小的是( )
A.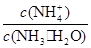 | B.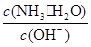 |
| C.c(H+)×c(OH-) | D.OH-的物质的量 |
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有C1-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |