��Ŀ����
����Ŀ����ij����FeCl2��FeCl3��CuCl2�Ĺ�ҵ��Һ�л���ͭ���Ʊ��Ȼ���������������£�
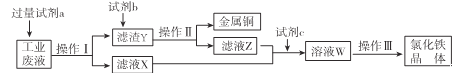
��֪��FeCl3�ڼ����������ˮ��Ӧ����Fe��OH��3��
�ش��������⣺
��1���Լ�a�� ____________��������ԭ��______________________��
��2����������___________���õ��IJ�������___________________________��
��3�����Լ�C��Cl2����Ӧ�����ӷ���ʽ�� __________________________��
��4����ҺX��Z�ж���ͬһ�����ʣ������ʵ����֤�����ʵ����ӣ�___________��
��5��������Ӧ������______��
A ���� B���� C ��Һ D �ᾧ
���𰸡� Fe ʹ�Ȼ���/�Ȼ�ͭ��ȫ��Ӧ ���� �ձ� ©�� ������ 2Fe2++Cl2=2Fe2+ + 2Cl- ȡδ֪Һ����,�μ�KSCN��Һ,�����������ٵμ���ˮ��,��Һ��ΪѪ��ɫ.֤������Fe2+����ȡδ֪Һ����,�μ�ϡ�����ữ��AgNO3��Һ,������ɫ����.֤������Cl-. D
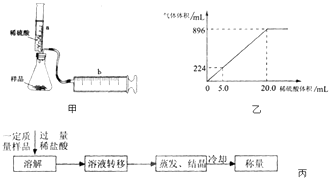
�������������֪���������Ʊ��Ȼ������壬������a���Ա��Լ�b�ܽ⣬���ܽ����Ժ���ҺX�ϲ����Ʊ��Ȼ���������a������b�����ᡢc��������
��1������֪aΪFe������������Լ�Fe��Ŀ����ʹ�Ȼ������Ȼ�ͭ��ַ�Ӧ��
��2������II�ǵõ�����ͭ����Һ�����Բ���IIӦ�ǹ��ˣ��õ��IJ����������ձ���©������������
��3����������I�õ�����ҺX��FeCl2��Һ����ҺZ���Ȼ���������������Һ��ͨ���������������ӷ�Ӧ��2Fe2++Cl2=2Fe3++2Cl-��
��4���ӣ�3���ķ�����֪���е�ͬһ����ΪFeCl2����������ӵķ����ǣ�ȡδ֪Һ����,�μ�KSCN��Һ,�����������ٵμ���ˮ��,��Һ��ΪѪ��ɫ.֤������Fe2+����ȡδ֪Һ����,�μ�ϡ�����ữ��AgNO3��Һ,������ɫ����.֤������Cl-��
��5������III��Ϊ�˴���Һ�л�þ��壬Ӧ��ȷ����Һ�д�������������£�����Ũ������ȴ�ᾧ��Ӧ���ýᾧ�ķ�ʽ�õ��Ȼ������壬��ѡD��

 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�