题目内容
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu + 8HNO3 (稀)=3Cu(NO3)2 + 2NO↑+ 4H2O。
(1)被氧化的元素是_______,被还原的元素是__________,发生氧化反应的物质是________,发生还原反应的物质是______________。
(2)用双线桥法表示反应电子得失的方向和数目:__________________________________。
(3)用单线桥法表示反应电子得失的方向和数目:__________________________________。
【答案】Cu NCuHNO3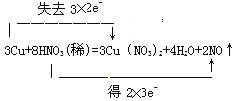
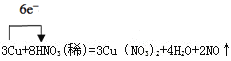
【解析】
(1)由方程式可知:铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,NHO3发生还原反应.。
(2)双线桥法,是两条线一条由氧化剂指向还原产物,线的上方表示得失电子的个数,及化合价升降。另一条线由还原剂指向氧化产物,线的上方表示得失电子的个数,及化合价升降。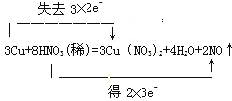 。
。
(3)单线桥是一条线从还原剂出发箭头指向氧化剂,并在线的上方表示出转移电子的个数,只简单表示电子转移的个数和方向。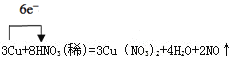 。
。

【题目】下列事实所对应的离子方程式正确的是四氯化钛的浓溶液制备水合二氧化钛
选项 | 事实 | 离子方程式 |
A | 四氯化钛的浓溶液制备水合二氧化钛 | Ti4++(X+2)H2O |
B | 硫代硫酸钠溶液中滴加盐酸有淡黄色沉淀产生 | S2O32-+6H+ =2S↓+3H2O |
C | 碳酸钠溶液显碱性 | 2CO32- +H3O+ |
D | 碘化亚铁溶液中滴加少量溴水,溶液变为黄色 | 2Fe2++Br2=2Fe3++2Br- |
A. A B. B C. C D. D
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法不正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为放热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)>c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。

