题目内容
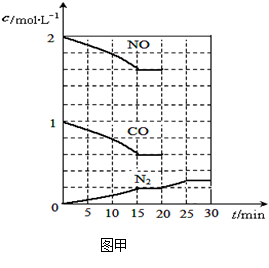
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )


| A.a点的溶液呈中性 |
| B.b点到c点之间发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— =Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |
D
试题分析:A、a点发生的反应为2Al3++3Ba2++3(SO4)2-+6OH-=2Al(OH)3↓+3BaSO4↓此时溶液中的溶质为(NH4)2SO4溶液为酸性,错误;B、发生的反应为Al(OH)3+OH-=AlO2-+2H2O,错误;C、发生的反应为NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+NH3·H2O+2H2O加入的体积应为250mL,错误;D、发生的反应为NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+NH3·H2O+2H2O,溶液显碱性,正确。

练习册系列答案
相关题目
 Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH— NH3↑+H2O
NH3↑+H2O



 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。