题目内容
7.目前市场上主流手机所配的电池基本上都是锂离子电池.它的负极材料是金属锂和碳的复合材料,组成为C6Li,其中碳作为金属锂的载体,电解质为一种能传导Li+的有机导体或高分子材料.这种锂离子电池的电池反应为0.45Li+Li0.55CoO2$?_{充电}^{放电}$LiCoO2;下列说法不正确的是( )| A. | 放电时电池内部Li+向正极移动 | |
| B. | 该电池不能选用水做溶剂的电解质 | |
| C. | 充电时,正极的电极反应式:0.45Li++Li0.55CoO2+0.45e-=LiCoO2 | |
| D. | 充电时,外接电源的正极与电池上标注“+”的电极连接 |
分析 A.原电池放电时,阳离子向正极移动;
B.锂属于较活泼金属,能和水反应;
C.充电时,阳极发生氧化反应;
D.充电时,电池上标注“+”的电极作阳极.
解答 解:A.原电池放电时,阳离子向正极移动,所以锂离子向正极移动,故A正确;
B.原电池负极是锂单质,能和水反应生成氢气,所以不能用含有水的溶液作电解质溶液,故B正确;
C.充电时,阳极发生氧化反应,电极方程式为LiCoO2-0.45e-=0.45Li++Li0.55CoO2,故C错误;
D.充电时电池正极将发生氧化反应而作阳极,所以电池“+”与电源正极相连,故D正确;
故选C.
点评 本题考查化学新型电源,明确电极上发生的反应是解本题关键,结合物质的性质来分析解答,易错选项是C,注意电解池与原电池的区别,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在一定条件下,4克H2完全反应生成水蒸汽放出2b kJ热量,下列热化学方程式正确的是( )
| A. | 2H2+O2═2H2O△H=-2b kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+b kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-2b kJ/mol | D. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+b kJ/mol |
2.维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6(相对分子质量为176),人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
(1)测定目的:测定××牌软包装橙汁维生素C含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品及试剂:
①仪器和用品(自选,略).
②试剂:指示剂淀粉(填名称)、浓度为7.50×10-3mol•L-1标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器:检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(或移液管)(填仪器名称)向锥形瓶中移入25.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位的名称),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点.滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
(5)数据记录与处理.滴定中消耗标准碘溶液的体积见表,请计算此橙汁中维生素C的含量是792mg•L-1.
(1)测定目的:测定××牌软包装橙汁维生素C含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品及试剂:
①仪器和用品(自选,略).
②试剂:指示剂淀粉(填名称)、浓度为7.50×10-3mol•L-1标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器:检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(或移液管)(填仪器名称)向锥形瓶中移入25.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位的名称),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点.滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
12.下列关于金属的说法不正确的是( )
| A. | 金属钠与O2反应,条件不同,产物不同 | |
| B. | 铝制餐具不能长期存放酸性食物,但可长期存放碱性食物 | |
| C. | 金属钠着火时,用细沙覆盖灭火 | |
| D. | 将金属钠投入FeCl3溶液中,生成红褐色沉淀,同时放出气体 |
19.碳酸钠和碳酸氢钠的化学性质有许多相似的地方,但也存在差异,以下关于两者性质的比较正确的是( )
| A. | 两者水溶液均呈碱性,碳酸钠俗名纯碱,物质分类属于碱 | |
| B. | 两者均和稀盐酸反应产生CO2,但碳酸氢钠和盐酸反应更剧烈 | |
| C. | 用酒精灯加热时两者均可发生分解反应,但碳酸氢钠更易分解 | |
| D. | 两者均可和澄清石灰水发生反应,但碳酸氢钠反应时无沉淀 |
10.在一定条件下将1mol CO和1mol H2O(g)放入密闭容器中进行反应CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡时测得CO2 0.6mol,再向其中通入4mol H2O达新平衡后CO2的物质的量为( )
| A. | 0.6mol | B. | 1mol | C. | 1.3mol | D. | 0.8mol |
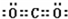 .
.