题目内容
某N2和H2的混合气体,对氦气的相对密度是1.8,取0.5 mol该混合气体,在固定体积的容器中进行合成氨反应,平衡时压强是反应前压强的0.8倍,完成下列问题:(1)原料气的平均摩尔质量为____________。
(2)原料气中,N2与H2的体积比为______________。
(3)在合成氨反应中,生成NH3的物质的量是________,平衡时,混合气体中N2和H2的物质的量之比为________。
(1)7.2 g·mol-1
(2)1∶4
(3)0.1 mol 1∶5
解析:(1)![]() =4 g·mol-1×1.8=7.2 g·mol-1
=4 g·mol-1×1.8=7.2 g·mol-1
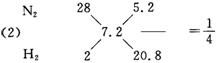
(3)0.5 mol混合气体中含N2为0.1 mol,含H2为0.4 mol。
设反应生成NH3的物质的量为x。
N2 + 3H2 ![]() 2NH3
2NH3
起始n: 0.1 mol 0.4 mol 0
变化n: ![]()
![]() x
x
平衡n: 0.1 mol-![]() 0.4 mol-
0.4 mol-![]() x
x
平衡时气体的总物质的量为:
(0.1 mol-![]() )+(0.4 mol-
)+(0.4 mol-![]() )+x=0.5 mol-x
)+x=0.5 mol-x
据题意:![]() ,则
,则![]()
解得:x=0.1 mol
平衡时:n(N2)=0.1 mol-![]() =0.05 mol
=0.05 mol
n(H2)=0.4 mol-![]() ×0.1 mol=0.25 mol
×0.1 mol=0.25 mol
故n(N2)∶n(H2)=0.05∶0.25=1∶5。

练习册系列答案
相关题目