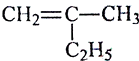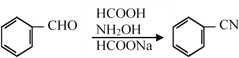题目内容
【题目】下列有关石墨晶体的说法正确的是( )
A. 由于石墨晶体导电,所以它是金属晶体
B. 由于石墨的熔点很高,所以它是原子晶体
C. 由于石墨质软,所以它是分子晶体
D. 石墨晶体是一种混合晶体
【答案】D
【解析】石墨晶体中既有共价键,又有金属键,还有范德华力,因此它是一种混合晶体。答案选D。

【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH![]() (g)+1/2O
(g)+1/2O![]() (g)══CO(g)+2H
(g)══CO(g)+2H![]() (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol![]() ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH![]() (g)+2O
(g)+2O![]() (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol![]() ;
;
③CH![]() (g)+CO
(g)+CO![]() (g)=2CO(g)+2H
(g)=2CO(g)+2H![]() (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol![]() ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
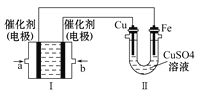
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu![]() 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。