��Ŀ����
ʵ����ģ�����ij�Ͼɺ�����������Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO�ȣ�����Ni2O3���乤������Ϊ��
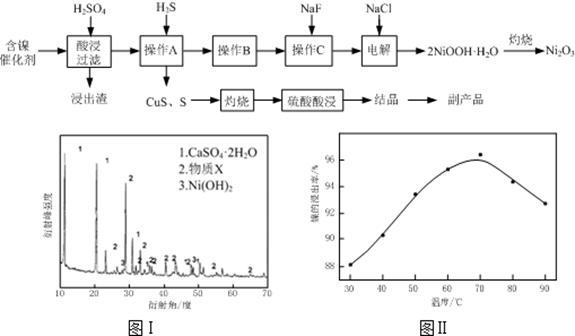
��1������ͼ����ʾ��X��������ͼ�ף���֪����������������Ҫ�ɷ֣����С�����X��Ϊ ��ͼ���ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ��ͣ���������Ni(OH)2�� ��������ԭ���� ��
��2�����������С�����Ʒ���Ļ�ѧʽΪ ��
��3����֪�й��������↑ʼ�����ͳ�����ȫ��pH���±���
����B��Ϊ�˳�ȥ��Һ�е���Ԫ�أ�ijͬѧ���������ʵ�鷽���������A���õ���Һ�м���NaOH��Һ��������ҺpHΪ3.7��7.7�����ã����ˡ���Ը�ʵ�鷽����������
����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��4������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10��3mol��L��1����Ca2+��Ũ��Ϊ mol��L��1��������ʱCaF2���ܶȻ�����Ϊ2.7��10��11��
��5��������2NiOOH��H2O��ԭ����������
�ټ���������Cl��������������ΪClO����
��Ni2+��ClO����������2NiOOH��H2O������
�ڢڲ���Ӧ�����ӷ���ʽΪ ��

��1������ͼ����ʾ��X��������ͼ�ף���֪����������������Ҫ�ɷ֣����С�����X��Ϊ ��ͼ���ʾ���Ľ��������¶ȵĹ�ϵ���������¶ȸ���70��ʱ�����Ľ����ʽ��ͣ���������Ni(OH)2�� ��������ԭ���� ��
��2�����������С�����Ʒ���Ļ�ѧʽΪ ��
��3����֪�й��������↑ʼ�����ͳ�����ȫ��pH���±���
| �������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| ��ʼ������pH | 1.5 | 6.5 | 7.7 |
| ������ȫ��pH | 3.7 | 9.7 | 9.2 |
����ԭ������ȷ����˵�����ɣ���ԭ������������Ը�������
��4������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F��Ũ��Ϊ3��10��3mol��L��1����Ca2+��Ũ��Ϊ mol��L��1��������ʱCaF2���ܶȻ�����Ϊ2.7��10��11��
��5��������2NiOOH��H2O��ԭ����������
�ټ���������Cl��������������ΪClO����
��Ni2+��ClO����������2NiOOH��H2O������
�ڢڲ���Ӧ�����ӷ���ʽΪ ��
��12�֣���1��BaSO4 �¶����ߣ�Ni2+��ˮ��̶�����
��2��CuSO4��5H2O
��3�����������ڵ���pHǰ��Ӧ������Һ�м���H2O2��ʹ��Һ�е�Fe2+����ΪFe3+
��4��3��10��6
��5��ClO����2Ni2+��4OH��=2NiOOH��H2O��Cl��
������֪���������������ᷴӦ��Ca2+��Ba2+�γɳ�����ͨ���������彫Cu2+����������B��ȥFe3+������C��ȥCa2+�������Ȼ��Ƶ����������Һ�õ�2NiOOH��H2O��
��2��CuSO4��5H2O
��3�����������ڵ���pHǰ��Ӧ������Һ�м���H2O2��ʹ��Һ�е�Fe2+����ΪFe3+
��4��3��10��6
��5��ClO����2Ni2+��4OH��=2NiOOH��H2O��Cl��
������֪���������������ᷴӦ��Ca2+��Ba2+�γɳ�����ͨ���������彫Cu2+����������B��ȥFe3+������C��ȥCa2+�������Ȼ��Ƶ����������Һ�õ�2NiOOH��H2O��
�����������1�������ᷴӦ���������ij�����ơ�����������о������ᱵ����������XΪBaSO4�����������¶����ߣ�Ni2+��ˮ��̶����Ӷ��������Ľ����ʽ��ͣ���������Ni��OH��2��������
��2������CuS��S���պ�����ϡ��������������ͭ�����Ը���ƷӦ���ǵ�������CuSO4?5H2O��
��3������������������Һ������Һ��pHֵ�������������ʣ�����pHΪ3.7��7.7���������ӳ�������ȫ�����Է����Ǵ���ģ���ȷ�IJ���Ӧ�����ڵ���pHǰ��Ӧ������Һ�м���H2O2��ʹ��Һ�е�Fe2+����ΪFe3+��
��4�����ݳ���ʱCaF2���ܶȻ�����Ϊ2.7��10-11��֪����Һ��F-Ũ��Ϊ3��10-3 mol?L-1����Ca2+��Ũ��Ϊ2.7��10-11/(3��10-3)2= 3��10��6mol?L-1��
��5��Ni2+��ClO-��������2NiOOH?H2O�������仹ԭ�����������ӣ�����ݵ��ӵĵ�ʧ�غ��֪���ڢڲ���Ӧ�����ӷ���ʽΪClO-+2Ni2++4OH-=2NiOOH?H2O+Cl-��

��ϰ��ϵ�д�
�����Ŀ